-
紫茎泽兰(Ageratina adenophora)菊科泽兰属多年生草本或成半灌木状植物。原产地为墨西哥,主要分布于中国、美国、澳大利亚、新西兰等地。1960年至今,紫茎泽兰主要分布从云南省南部地区,蔓延至我国四川、贵州、西藏广西等多个省份地区,遍布高达11平方公里,已经严重影响到农业和林业的生产。为将紫茎泽兰变废为宝,研究方向已逐步从防治转向利用[1, 2]。目前对于紫茎泽兰的研究有多个方面:紫茎泽兰的入侵基质与防治技术[3]、紫茎泽兰化感作用[4]、紫茎泽兰对生态的破坏作用[5]、紫茎泽兰入侵对土壤微生物的影响[6]及紫茎泽兰相关资源综合利用等多个方面[7],有研究通过从紫茎泽兰内提取出能够对螨虫、蚜虫等林业害虫有致死效果的提取物,应用于林业害虫防治的方面[8][9]。对紫茎泽兰的防治常通过喷洒除草剂和人工收割的方式进行处理,而收割下来的紫茎泽兰能够作为有机肥底物进行再利用[10],也有通过加工处理后作为饲料[11]或者作为木糖醇的发酵底物[12]。
然而紫茎泽兰对与植物幼苗[13]以及动物都有着一定的毒性,需要通过相应脱毒处理或者发酵过后才能够加以应用[14, 15]。将紫茎泽兰直接用于微生物培养基方面能够减少紫茎泽兰的加工步骤,培养基内的剩余残渣还可加工成肥料的产品回收利用,是一种新型的紫茎泽兰资源利用的方法。将紫茎泽兰应用于微生物繁殖方面能够快速的提高发酵罐内微生物数量,但因紫茎泽兰有着多种挥发性物质,会对发酵类产品品质造成影响[16],所以不适合应用于食品类微生物上,但更加适合应用于微生物菌肥、沼气生产用微生物等工程类微生物的快速繁殖上有着较好的应用前景。有研究发现,紫茎泽兰入侵后显著改变土壤内微生物群落,其入侵区域土壤内的固氮菌数量是未入侵区域的8倍以上[17],进而提升周边土壤内的硝态氮、铵态氮、有效磷、速效钾的含量,提升紫茎泽兰的繁殖速度[18],表明紫茎泽兰能够促进微生物的繁殖。为了探索紫茎泽兰是否能够对枯草芽孢杆菌的繁殖起到促进作用,本文尝试向培养基内增加紫茎泽兰粉末探索微生物繁殖的动态变化,为紫茎泽兰资源的利用提供一种新的方法。
HTML
-
实验材料:枯草芽孢杆菌(竹类病虫防控与资源开发四川省重点实验室)、马铃薯葡萄糖琼脂培养基(PDA)(北京奥博星生物技术有限责任公司)、氯化钠、酵母提取物、蛋白胨(成都市科龙化工试剂厂);
紫茎泽兰干粉:取自四川省乐山市犍为县道路边坡,60 ℃烘干24 h,将其根茎、枝条叶片打磨成粉过40目筛网后收集粉末备用。
-
菌落计数培养基使用马铃薯葡萄糖琼脂培养基(PDA):称取37.0 gPDA干粉,加入1000 mL蒸馏水中,加热煮沸溶解后,放置于121 ℃高压灭菌15 min,倾倒与已灭菌好的培养皿内备用。
LB培养基:蛋白胨10 g,酵母提取物5 g,氯化钠10 g,加入950 mL蒸馏水后用5 mol·L−1 NaOH调节pH值至7.0,定容至1000 mL,121 ℃高压灭菌15 min。
菌液准备:将枯草芽孢杆菌接种在液体LB培养基内,当菌液内菌落数量达到10−6时,放于4 ℃冰箱内备用。
-
实验分为4个组,LB培养基作为对照组CK,培养基A、B、C组在LB培养基的基础上添加紫茎泽兰不同部位粉末(见表1),每个组设置3个重复,121 ℃高压灭菌15 min。每组液体培养基灭菌后加入1 mL枯草芽孢杆菌菌液,放置在30 ℃、120 r·min−1培养,在接种后每隔24 h统计1次培养液内枯草芽孢杆菌数量,持续5 d。
采用平板涂布法统计枯草芽孢杆菌数量:吸取1 mL培养基内液体到刻度试管内1,加入9 mL无菌水此时稀释倍数为10倍,吸取试管1内菌液1 mL至试管2内记为10−2,加入9 mL无菌水,依次类推至试管内菌液稀释浓度为10−9;依次吸取试管1~10内的菌液0.5 mL在马铃薯葡萄糖培养基(PDA)内,涂布均匀每个浓度4个重复,放置于28 ℃培养箱内培养24 h;选择菌落数于30~300之间的培养基,用Microsoft Excel软件统计微生物数量。
培养基 粉末部位 浓度g/L CK 无 A1 根系粉末 0.5 A2 根系粉末 1.0 A3 根系粉末 1.5 B1 茎部粉末 0.5 B2 茎部粉末 1.0 B3 茎部粉末 1.5 C1 叶片粉末 0.5 C2 叶片粉末 1.0 C3 叶片粉末 1.5 Table 1. Composition of the culture medium
1.1. 试验材料
1.2. 试验处理与方法
1.3. 研究方法
1.3.1. 不同部位对枯草芽孢杆菌生长的影响
-
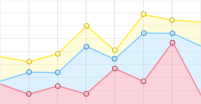
通过添加紫茎泽兰根系粉末后,微生物数量有着明显提升。根系粉末添加组A3内枯草芽孢杆菌数量在第3天达到最高值91×106 CFU·mL−1,而CK组在第四天才达到最大浓度46×106 CFU·mL−1(见表2);微生物数量随着根系粉末添加量增加而增加,A2和A3组在第3天达到最大值,A2组在第2天增长速度达到最高139.39%,之后出现不同程度的下降,下降速率最快的为A3组,第5天下降数值达到49.25%(见表3)。
单位:(×106 CFU·mL−1) 时间 1 d 2 d 3 d 4 d 5 d CK 13 24 39 46 18 A1 21 28 47 51 40 A2 33 79 89 78 46 A3 36 75 91 67 34 Table 2. Statistics of effective viable bacteria in group A
-
添加有紫茎泽兰茎部粉末的培养基内,微生物数量有一定程度的提升,微生物数量增加最多为B3组达52×106 CFU·mL−1(见表4),高出对照组13.04%,微生物增长速度最高的为B2组,在第3天增长率达到100%;对于微生物衰减速率而言,试验组B1、B2微生物在第三天达到最大值,B3则是第四天;之后出现不同程度的下降,其中最明显的为B1组减少速率最高达到44.74%,但减少速率仍比试验组低16.07%(见表5)。
单位:% 时间/d CK 培养基A1 培养基A2 培养基A3 1−2 84.62 33.33 139.39 108.33 2−3 62.5 67.86 12.66 21.33 3−4 17.95 8.51 −12.36 −26.37 4−5 −60.87 −21.57 −41.03 −49.25 Table 3. Growth rate of Bacillus subtilis in group A
单位:(×106 CFU·mL−1) 时间 1 d 2 d 3 d 4 d 5 d CK 13 24 39 46 18 B1 15 26 44 38 21 B2 13 24 48 41 34 B3 18 33 46 52 41 Table 4. Statistics of effective viable bacteriain group B
单位:% 时间/d CK 培养基B1 培养基B2 培养基B3 1−2 84.62 73.33 84.62 83.33 2−3 62.5 69.23 100 39.39 3−4 17.95 −13.64 −14.58 13.04 4−5 −60.87 −44.74 −17.07 −21.15 Table 5. Growth rate of Bacillus subtilis in group B
-
紫茎泽兰叶片粉末对微生物的促生效果相比于根、茎粉末的效果较低,但仍有促进微生物繁殖的作用,C2组微生物数量最大值比对照组少15.21%,C3在第3天达到最大值51×106 CFU·mL−1(见表6),比对照组高出10.87%;C组中微生物增长率在1到3天均高于对照组,最高增加率为C3组96.15%,在第4天开始出现微生物数量衰减,C2、C3组则是第三天,最高减少量为35.9%(见表7)。
单位:(×106 CFU·mL−1) 时间 1 d 2 d 3 d 4 d 5 d CK 13 24 39 46 18 C1 11 21 35 39 25 C2 13 25 48 42 28 C3 16 26 51 43 38 Table 6. Statistics of effective viable bacteriain group C
单位:% 时间/d CK 培养基C1 培养基C2 培养基C3 1−2 84.62 90.91 92.31 62.5 2−3 62.5 66.67 92 96.15 3−4 17.95 11.43 −12.5 −15.69 4−5 −60.87 −35.9 −33.33 −11.63 Table 7. Growth rate of Bacillus subtilis in group C
2.1. 紫茎泽兰根系粉末
2.2. 紫茎泽兰茎部粉末
2.3. 紫茎泽兰茎部粉末
-
添加有紫茎泽兰根、茎、叶干粉的培养基内微生物数量都有不同程度的提升,紫茎泽兰根茎干粉能够更有效地提升枯草芽孢杆菌在LB液体培养基内的繁殖速度,特别是在接种菌种的48 h之内,添加有紫茎泽兰根茎粉末的培养基内微生物的繁殖速度高出对照组54.78%,最高数量为对照组的1.9倍。紫茎泽兰根干粉不同用量对枯草芽孢杆菌繁殖促进效果不一样,在1~3 d内,0.5 g·L−1根干粉用量促进效果不如1 g·L−1和1.5 g·L−1,1 g·L−1和1.5 g·L−1根干粉用量促进效果相近;3~5 d内1.5 g·L−1根干粉用量促进效果不如1 g·L−1根干粉用量促进效果,但都比对照组促进效果好,关于根干粉不同用量如何对枯草芽孢杆菌繁殖促进作用有待进一步研究。茎、叶的干粉不同用量对枯草芽孢杆菌繁殖促进效果相近,其作用时间对枯草芽孢杆菌繁殖效果也相差不大。培养基内微生物快速生长,对营养物质的消耗则会增加,如果未能及时补充培养液中的养料物质,培养液内微生物繁殖速度则会逐渐衰减甚至出现逆增长的情况[19]。这也是试验组中添加有紫荆泽兰粉末的培养基更快出现微生物繁殖逆增长的原因,但是试验组中微生物衰减的速度相比对照组更加缓慢,推测是因为培养基内的紫茎泽兰粉末被微生物缓慢分解,提供了部分养料,减缓了培养基内微生物衰亡的速度。
本实验并未对微生物发酵液内物质的变化进行检测分析,在未来将会对培养接内营养物质和有毒物质的动态监测分析,进一步了解紫茎泽兰对微生物促生的机理,并和其他外来入侵植物对微生物生长的促进效果进行对比,寻找效果更加的微生物发酵添加物。


















 DownLoad:
DownLoad: