-
“绿绒蒿”是罂粟科(Papaveraceae)绿绒蒿属(Meconopsis)植物的统称,是横断山脉众多高山植物中的明星物种,有着“高原美人”之称,其花型硕大艳丽、姿态优美,气质惊艳,是著名且有巨大育种潜力的高山野生花卉。同时还是传统藏医药用植物,有清热解毒、消炎、止痛、利尿等功效[1],药用部位为花、果实或全草,该药材收载于《中华人民共和国卫生部药品标准·藏药》第一册[2]。该属建立于1814年,全属共49种,中国分布有38种[3,4],主要生长在四川西南部、云南西北部、西藏东南部和东喜马拉雅南坡,属于北温带植物区系成分[5]。
由于该属生长环境特殊,多位于横断山脉高寒之地,其昼夜温差大、年度冰雪覆盖时间长,地理气候条件特殊、恶劣,其种子发芽率和自然繁育率较低,要开发绿绒蒿属植物的观赏和药用价值,需要把绿绒蒿从高海拔地区引种到中低海拔地区,使它们逐步适应温暖的气候[5]。种子萌发是植物生命中非常重要的环节,是植物成功实现天然更新的关键过程,需要适宜的温度、水分或光照条件[6,7]。
全缘叶绿绒蒿(Meconopsis integrifolia (Maxim.) Franch.)和总状绿绒蒿(Meconopsis racemosa Maxim.)在四川较为常见、分布较广,是四川具有代表性的2种绿绒蒿。全缘叶绿绒蒿花为黄色、总状绿绒蒿花为蓝紫色或深蓝色,均为总状花序,数朵花冠簇拥在茎上部,亭亭玉立,具有非常高的观赏价值[8]。
目前,国内对绿绒蒿化学成分及药理活性方面的研究较多,对种子萌发繁育方面的研究不多,以总状绿绒蒿和全缘叶绿绒蒿两种种子为试材,探讨不同处理方法对这两种绿绒蒿种子萌发特性的影响。
-
供试材料为全缘叶绿绒蒿和总状绿绒蒿成熟的种子,材料于2020年10月采于四川省阿坝藏族羌族自治州小金县巴郎山(N102°53′19.32″ E30°54′43.59″ H4450m),种子在实验室自然干燥后除去杂质,选取饱满的种子装入信封后储藏。
-
随机选取采集的全缘叶绿绒蒿和总状绿绒蒿种子,用2%双氧水消毒后用蒸馏水清洗数遍,经过不同试验处理,置于铺有两层滤纸的培养皿中,于光照培养箱中进行种子萌发实验。
-
①不同GA3浓度处理对绿绒蒿种子萌发的影响
GA3浓度设置为0、100、200、300 mg/L共4个处理,随机选取种子,在不同浓度的 GA3溶液中浸泡12 h,每60粒作为1个处理,每个处理重复3次,其他条件恒定。
②GA3不同浸泡时间处理对绿绒蒿种子萌发的影响
浸泡时间设置为0 h、12 h、18 h、24 h共4个处理,随机选取种子,在150 mg/L GA3溶液中浸泡不同时间,每60粒作为1个处理,每个处理重复3次,其他条件恒定。
③不同温度处理对绿绒蒿种子萌发的影响:
温度设置为20℃(全天)、20℃/10℃(昼夜交替各12h)、25℃(全天)和25℃/15℃(昼夜交替各12h)共4个处理共4个处理,随机选取种子,在150 mg·L−1 GA3溶液中浸泡12 h,每60粒作为1个处理,其他条件恒定。
④不同光照处理对绿绒蒿种子萌发的影响:
光照设置为全光照、12 h光照/12 h黑暗交替、全黑暗,共3个处理,随机选取种子,在150 mg·L−1 GA3溶液中浸泡12 h,每60粒作为1个处理,每个处理重复3次,其他条件恒定。
-
以上种子萌发实验,以芽长与种子等长作为发芽标准,从处理当天开始,每24 h记录每皿中萌发的种子数量,并移出已萌发的种子,连续7 d培养皿中无新的种子萌发视为种子萌发进程结束。统计种子的发芽势、发芽率、发芽指数、发芽启动时间、发芽持续时间等。
①发芽启动时间,即萌发时滞,指从萌发试验开始到第1粒种子开始萌发所持续的天数;②发芽持续时间,即种子开始萌发到最后1粒种子萌发的总天数;③发芽率=种子发芽总数/供试种子总数×100%;④发芽势=日发芽种子最大时的发芽种子数/供试种子总数×100%;
⑤发芽指数=∑(Gt/Dt),其中Gt为t日内的发芽数,Dt为相应的发芽日数。
数据采用SPSS20.0统计软件进行差异显著性分析。
-
有研究表明GA3可以促进种子发芽[9-11],本试验通过增加 GA3含量来提高绿绒蒿种子萌发。由表1 可见,不同浓度的GA3处理对两种绿绒蒿发芽势、发芽率、发芽指数和发芽启动时间的影响存在显著差异。不用GA3处理的绿绒蒿种子仍然会发芽,但是发芽势、发芽率、发芽指数表现出明显的不同。
GA3浓度
Concentration
(mg·L−1)发芽指标Germination index 发芽势
Germination energy (%)发芽率
Germination rate (%)发芽指数
Germination index发芽启动时间
Germination start time(d)发芽持续时间
Germination duration time (d)0 8.89±0.56b 42.22±1.47c 20.43±0.61b 7.67±0.33a 19.00±0.58a 100 12.78±0.55a 72.78±1.47a 35.93±0.83a 4.00±0.00b 20.00±0.58a 200 11.11±0.56a 61.67±0.96b 36.28±1.40a 4.67±0.33b 21.00±0.58a 300 13.33±0.96a 59.45±1.47b 34.63±0.98a 4.33±0.33b 20.67±0.33a 注:同一列不同小写字母表示处理间有显著差异(P<0.05),下同。 Table 1. Effects of different concentrations of GA3 on seed germination of Meconopsis integrifolia
全缘叶绿绒蒿种子发芽率最大的为100 mg·L−1 GA3处理,与其他三组存在显著差异。发芽势最大的为300 mg·L−1 GA3处理,发芽指数最高的为200 mg·L−1 GA3处理,发芽持续时间最久的为200 mg·L−1 GA3处理,但是这三组数据和100 mg·L−1 GA3处理的发芽势、发芽指数和发芽持续时间不存在显著差异,所以100 mg·L−1 GA3处理最能促进全缘叶绿绒蒿种子萌发。
200 mg·L−1 GA3处理的总状绿绒蒿其发芽势最强,与其他三组存在差异显著。300 mg·L−1 GA3处理的总状绿绒蒿其发芽启动时间最短,发芽指数最高,发芽率最大,其发芽率和发芽启动时间与200 mg·L−1 GA3处理无显著差异,发芽指数与其有显著差异。考虑发芽指数的重要性,综合而言,总状绿绒蒿用300 mg·L−1 GA3处理最优,其次为200 mg·L−1 GA3处理。
GA3浓度
Concentration
(mg·L−1)发芽指标Germination index 发芽势
Germination energy (%)发芽率
Germination rate (%)发芽指数
Germination index发芽启动时间
Germination start time(d)发芽持续时间
Germination duration time (d)0 8.33±0.96c 38.89±1.47c 21.12±1.21c 7.67±0.33a 22.33±0.67a 100 11.11±0.56b 57.22±1.47b 35.24±1.70b 4.33±0.33b 20.00±0.58b 200 13.89±0.56a 62.22±1.47a 36.15±1.37b 4.33±0.33b 17.33±0.33c 300 11.11±0.56b 66.11±1.47a 41.06±1.66a 4.00±0.00b 19.67±0.33b Table 2. Effects of different concentrations of GA3 on seed germination of Meconopsis racemosa
-
GA3处理时间不同对两种绿绒蒿种子萌发影响不同,由表3可知,12 h处理发芽率最高,与其他处理差异显著,发芽持续时间最长,与24 h处理形成显著差异。18 h处理的发芽指数最大,与12 h处理无差异。24 h处理的发芽势最大,发芽启动时间最早,均与18 h处理无显著差异;三个处理均优于对照,说明即便少含量的激素也对植物种子萌发或植株生长起到了重要作用。
时间
Time
(h)发芽指标Germination index 发芽势
Germination energy (%)发芽率
Germination rate (%)发芽指数
Germination index发芽启动时间
Germination start time(d)发芽持续时间
Germination duration time (d)0 8.89±0.56c 42.22±1.47c 20.43±0.61c 7.67±0.33a 19.00±0.58a 12 12.22±0.56b 67.78±1.47a 34.43±0.12a 4.00±0.00b 19.67±0.33a 18 12.78±1.47ab 58.89±0.56b 35.57±0.17a 2.67±0.33c 18.67±0.33a 24 15.56±0.56a 41.67±2.55c 29.18±2.95b 2.33±0.33c 7.67±0.33b Table 3. Effects of different GA3 treatment time on seed germination of Meconopsis integrifolia
由表4可知,12 h处理和18 h处理其发芽势、发芽率和发芽指数差异不显著,为不同GA3处理时间对总状绿绒蒿种子萌发中较优的两个处理,18 h处理的发芽启动时间短于12 h, 18 h处理为总状绿绒蒿种子萌发中的最优处理。GA3处理时间更长或更短对总状绿绒蒿种子萌发的促进效果均会减弱。
时间
Time
(h)发芽指标Germination index 发芽势
Germination energy (%)发芽率
Germination rate (%)发芽指数
Germination index发芽启动时间
Germination start time(d)发芽持续时间
Germination duration time (d)0 8.33±0.96b 38.89±1.47b 21.12±1.21b 7.67±0.33a 22.33±0.67a 12 14.44±1.47a 63.89±2.42a 39.14±0.92a 3.67±0.33b 22.33±0.33a 18 16.11±0.56a 59.44±3.38a 44.15±5.76a 2.67±0.33c 16.67±0.88b 24 16.11±1.47a 30.56±2.00c 21.63±0.57b 2.00±0.00c 8.00±0.58c Table 4. Effects of different GA3 treatment time on seed germination of Meconopsis racemosa
-
温度是影响种子萌发的一个重要因素,适宜的温度可以促进种子萌发,温度过低或过高则会影响种子萌发[12]。不同温度对两种绿绒蒿子种子萌发有不同的影响,由表5可知,25℃/15℃处理的发芽势最好,与其他处理差异显著。25℃处理的发芽率和发芽指数最高,发芽启动时间最短,但发芽率和发芽期待时间与25℃/15℃处理无显著差异。综合分析,25℃处理与25℃/15℃处理最能促进全缘叶绿绒蒿种子萌发。
温度
Temperature发芽指标Germination index 发芽势
Germination energy (%)发芽率
Germination rate (%)发芽指数
Germination index发芽启动时间
Germination start time(d)发芽持续时间
Germination duration time (d)20℃ 12.22±0.56c 52.78±1.47c 28.89±21.40b 5.67±0.33b 17.67±0.88ab 20℃/10℃° 4.44±0.56d 26.67±0.96d 8.92±0.40c 10.67±0.33a 21.33±0.33a 25℃/15℃ 17.22±0.56a 61.11±2.42b 43.14±2.15a 3.00±0.00c 15.67±1.67b 25℃ 15±0.96b 70.56±2.40a 47.49±3.65a 2.33±0.33c 17.33±1.20b Table 5. Effects of different temperature treatments on seed germination of Meconopsis integrifolia
由表6可知,25℃处理的总状绿绒蒿种子其发芽率、发芽势、发芽指数最优,与其他处理差异显著,25℃处理的发芽启动时间最短,与25℃/15℃处理差异不显著,与其他处理差异显著,综合分析,25℃处理最能促进总状绿绒蒿种子萌发。
温度
Temperature发芽指标Germination index 发芽势
Germination energy (%)发芽率
Germination rate (%)发芽指数
Germination index发芽启动时间
Germination start time(d)发芽持续时间
Germination duration time (d)20℃ 10.56±0.56c 53.89±1.47b 30.42±0.99c 5.67±0.33b 18.67±1.2b 20℃/10℃° 5.56±0.56d 23.89±1.47c 7.49±0.79d 9.00±0.58a 19.67±0.33b 25℃/15℃ 14.44±0.56b 55.00±1.92b 44.76±3.97b 3.33±0.33c 24.67±0.88a 25℃ 19.44±1.47a 67.22±2a 53.42±2.59a 2.67±0.33c 17.33±0.33b Table 6. Effects of different temperature treatments on seed germination of Meconopsis racemosa
-
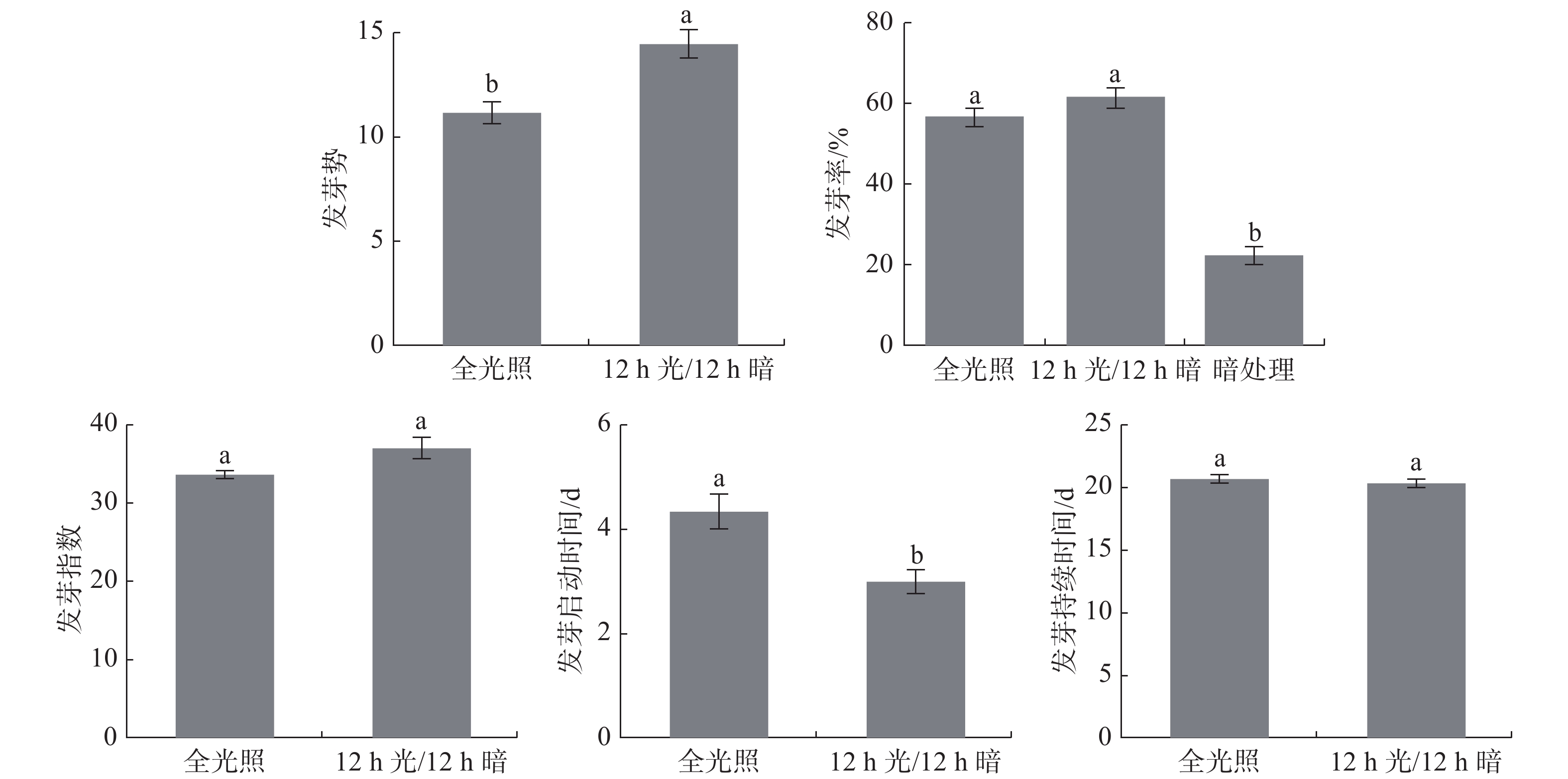
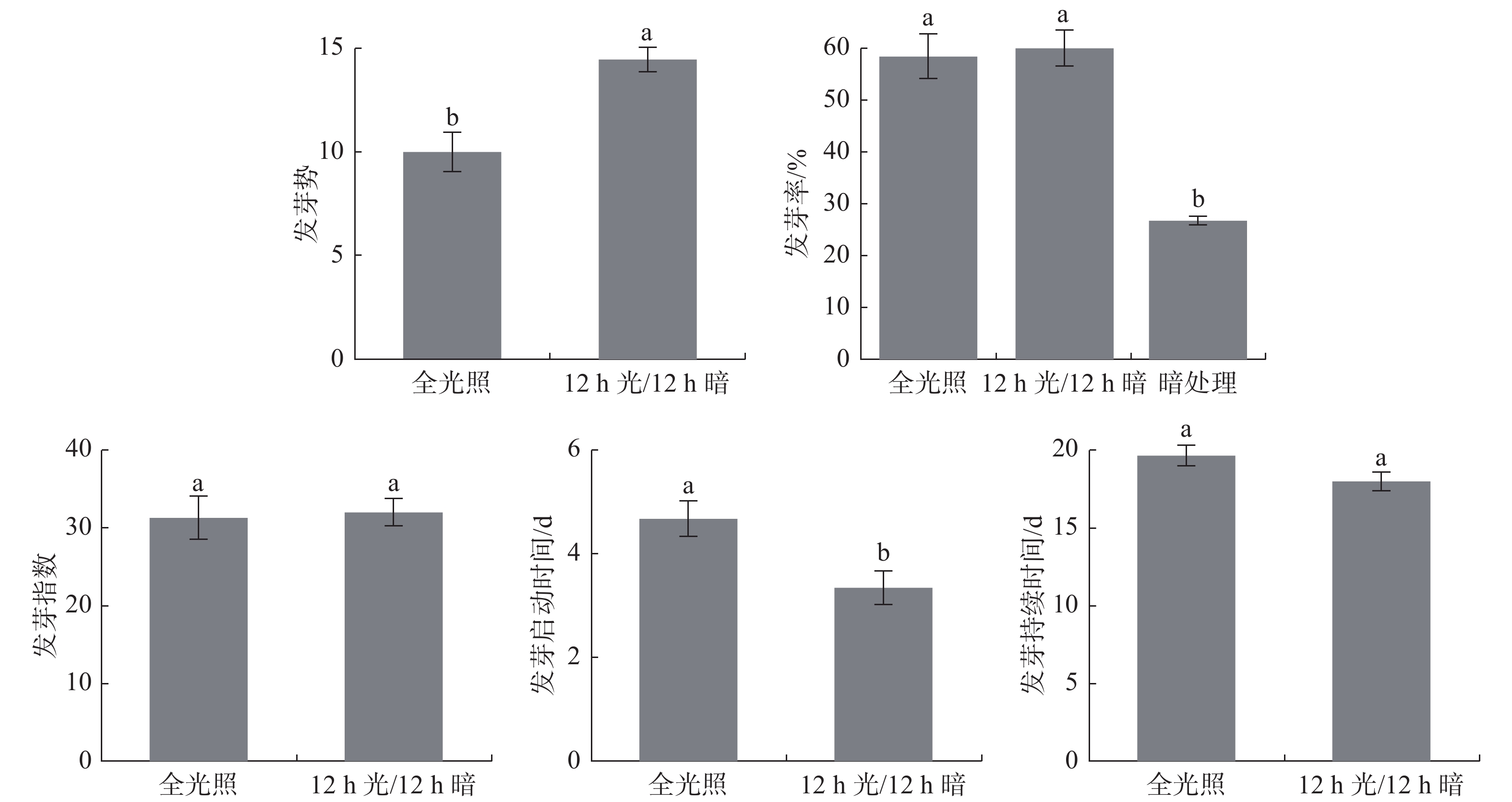
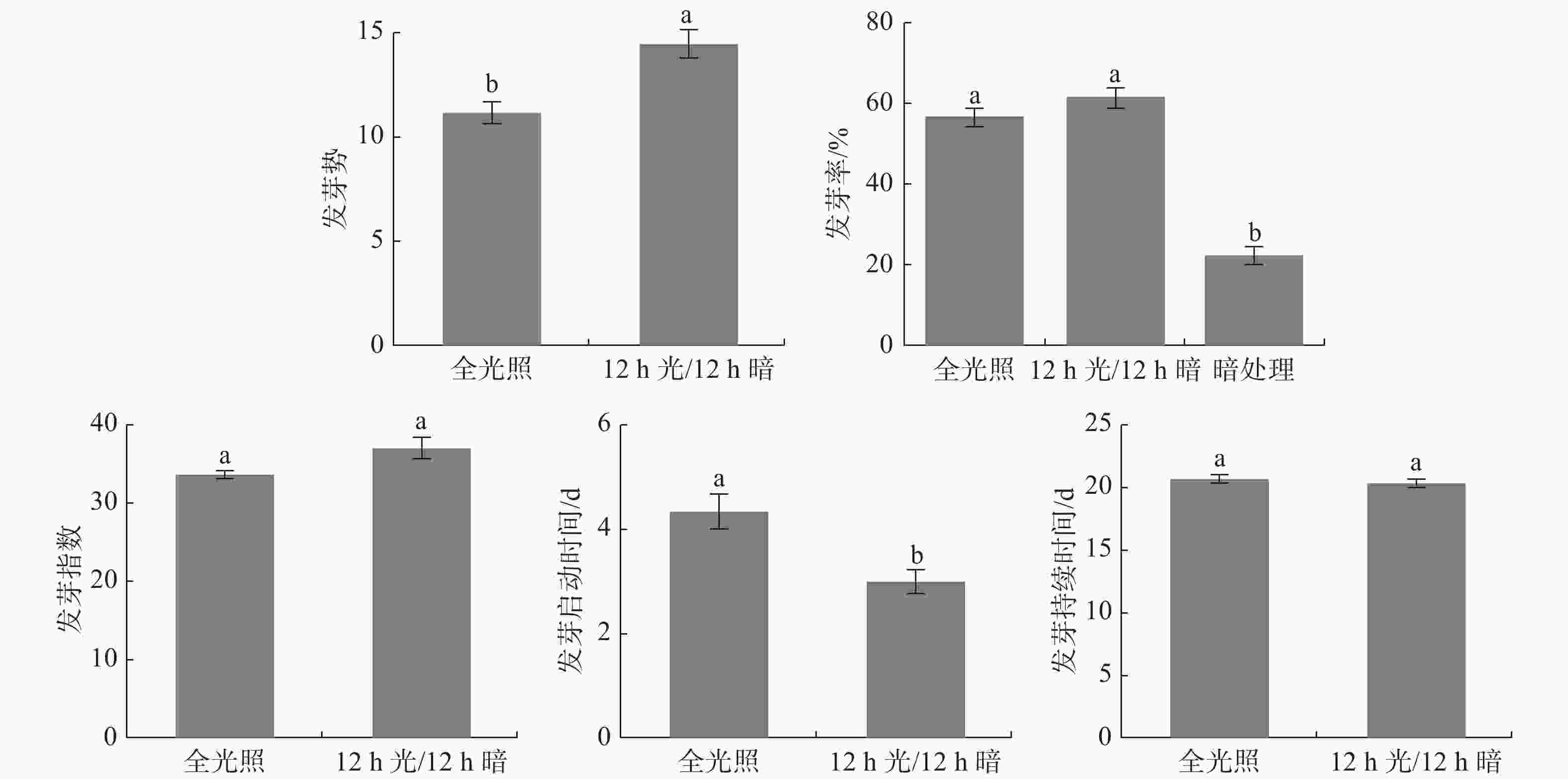
光照是影响种子萌发的重要因素,它可以促进或抑制某些种子萌发[13]。因为暗处理需要遮光,不能每天观察,因此,暗处理只比较发芽率。由图1可知暗处理全缘叶绿绒蒿种子仍然会萌发,但其发芽率远低于其他两个处理。12h光照/12h黑暗交替处理其发芽势最好,萌发启动时间最短,与全光照处理差异显著,而发芽率、发芽指数和发芽持续时间与全光照没有显著差异。综合而言,12h光照/12h黑暗交替处理最能促进全缘叶绿绒蒿种子萌发。
由图2可知,暗处理的总状叶绿绒蒿种子仍然会萌发,但是发芽率比有光照处理的低。12 h光照/12 h黑暗交替处理其发芽势最好,萌发启动时间最短,与全光照处理差异显著,而发芽率、发芽指数和发芽持续时间与全光照没有显著差异。综合而言,12 h光照/12 h黑暗交替处理最能促进总状绿绒蒿种子萌发。
-
绿绒蒿植物种子萌发困难存在较多原因,如种皮障碍、胚发育不完全、调节种子萌发与休眠的内在物质含量等引起[14]。前人做了一些研究,比如机械摩擦、赤霉素浸泡、红光照射等可以促进绿绒蒿种子萌发。在前人研究基础上,重点比较不同GA3浓度和浸泡处理、光照处理和温度处理对两种绿绒蒿种子萌发的影响。
GA3能够降低种子内过氧化物酶活性,增加生长素含量,提高细胞膜透性,促进细胞生长,从而可以有效促进绿绒蒿种子的萌发[15]。结果表明100 mg·L−1 GA3处理最能促进全缘叶绿绒蒿种子萌发,总状绿绒蒿用300mg·L−1 GA3处理最优,其次为200 mg·L−1 GA3处理。不同处理对两种绿绒蒿种子萌发效果不同,可能与两种绿绒蒿种子形态不一样相关。总状绿绒蒿种子长圆形,长1—2 mm,种皮具窗格状网纹;全缘叶绿绒蒿种子近肾形,长1—3 mm,种皮具明显的纵条纹及蜂窝状孔穴[3]。全缘叶绿绒蒿种子大,具有很多蜂窝状孔穴,与GA3接触更加充分,低浓度GA3则就可以促进萌发。
12 h处理和18 h处理为不同GA3处理时间对总状绿绒蒿种子萌发中最优的两个处理;全缘叶绿绒蒿种子GA3三个处理均优于对照,但三个处理在发芽势、发芽率、发芽指数各方面没有特别显著差异。
温度是影响种子萌发的一个重要因素,适宜的温度可以促进种子萌发,温度过低或过高则会影响种子萌发,甚至会导致种子失活[16],通过王朝文等研究20℃时的总状绿绒蒿种子的萌发效果最佳[15],廖捷敏等研究20℃条件下全缘叶绿绒蒿萌发率最高[17]。因为绿绒蒿在自然条件下温差不同,在前人在研究基础上,模拟研究了2种绿绒蒿在恒温和有温差处理情况下其种子萌发效果,结果表明25℃处理与25℃/15℃处理最能促进全缘叶绿绒蒿种子萌发,25℃处理最能促进总状绿绒蒿种子萌发。研究说明种子萌发温差不同,对种子萌发影响不大。
光照也是影响种子萌发的重要因素[18]。自然条件下,植物种子是在光照和黑暗交替环境下萌发,研究得出12 h光照/12 h黑暗交替处理最能促进全缘叶绿绒蒿和总状绿绒蒿种子萌发,说明模拟自然条件下黑暗和光照交替出现最有利于两种绿绒蒿种子萌发。本次研究发现暗处理的情况下种子也可以萌发,这可能与绿绒蒿种子的需光性和植物激素有一定关系,如番茄种子的需光性能被赤霉素处理解除,绿绒蒿种子的需光性是否与赤霉素相关,需要进一步试验研究[19]。全光照、12 h光照/12 h黑暗交替两种处理的发芽率比全黑暗处理发芽率高,且差异显著,这应该是光照对绿绒蒿种子萌发有促进作用。
Effect of different treatments on seed germination characteristics of two Meconopsis species
doi: 10.12172/202301130001
- Received Date: 2023-01-13
- Available Online: 2023-11-30
- Publish Date: 2024-04-25
-
Key words:
- Meconopsis integrifolia /
- Meconopsis racemosa /
- seed germination /
- GA3
Abstract: The effects of different GA3 Concentration, GA3 soaking time, temperature and light treatment on the seed germination of Meconopsis integrifolia and Meconopsis racemosa were compared, and the most favorable method for the seed germination of these two kinds of Artemisia annua was found. The results showed that: (1) 100 mg/L GA3 treatment could promote the seed germination of Meconopsis integrifolia seeds. Artemisia racemosa treated with 300mg/L GA3 was the best, followed by 200mg/L GA3. (2) 12h treatment and 18h treatment were the best two treatments for seed germination of Meconopsis racemosa with different GA3 treatment time. The seeds of Meconopsis integrifolia GA3 were better than the control. (3) 25 ℃ treatment and 25 ℃/15 ℃ treatment could promote the germination of Meconopsis integrifolia seeds, and 25 ℃ treatment could promote the germination of Meconopsis racemosa seeds. (4) 12h light/12h dark alternation treatment could promote the germination of Meconopsis integrifolia seeds and Meconopsis racemosa seeds.


















 DownLoad:
DownLoad: