-
红掌(Anthurium andraeaum)为天南星科花烛属多年生常绿草本植物,又名花烛、安祖花、幸运花、红苞芋等,红掌原产于中南美洲热带雨林,红掌株高50~80 cm,无茎,叶从根茎处抽出,叶被革质,具长叶柄,单生,叶色深绿,长圆心形,有光泽,全缘,叶脉凹陷。进入成年期以后,花依循一叶一花形式生长,自叶腋抽出,高出叶片,肉质佛焰状花序直立于苞片中,形如灯台,由于形态独特,寓意深刻,是花卉市场的中高档盆花的代表。
红掌的自然繁殖方式可分为分蘖繁殖和种子繁殖,分蘖繁殖效率慢,种子繁殖变异大,此两种方式均不能作为规模化繁育的首选[1],随着红掌组织培养技术的攻克,红掌组培苗已经成为市场红掌的主要来源。本研究以红掌品种“特仑萨”的分蘖芽为材料,研究了激素类型和浓度对愈伤组织诱导、不定芽再生、幼苗生根的影响,为改良红掌组培繁育技术提供新的试验支撑。
HTML
-
供试材料来源于成都市郫都区春天花乐园花卉市场的红掌品种“特仑萨”成品盆花,规格为120 mm双色盆,购买后的盆花放置在温室大棚内,常规养护管理,每7 d用500倍25%多菌灵溶液浇透一次。
-
待基部分株后,选择长1~2 cm的分蘖芽,剪下后带回实验室,在含有洗洁精的清水中擦拭芽表面,流水下冲洗干净后转入超净工作台,把芽投入含有75 mL 0.1%升汞溶液的150 mL中消毒8 min,期间不断摇晃三角瓶;用无菌水冲洗分蘖芽5次,每次不少于2 min后备用。
外植体转入不含有激素的基础培养基:MS+30 g·L–1蔗糖;pH 5.8。观察7 d后,淘汰掉污染的外植体,无菌外植体转入下一步试验。
-
以MS为基本培养基,6-BA和NAA分别为因素的两因素四水平正交试验,设计6-BA浓度为0.2 mg·L–1、0.5 mg·L–1、1.0 mg·L–1、2.0 mg·L–1,NAA浓度为0.01 mg·L–1、0.02 mg·L–1、0.05 mg·L–1、0.1 mg·L–1的愈伤组织诱导培养基试验。
每处理共接种30个外植体,分为3次重复,10个外植体/重复。培养30 d后,统计外植体生长情况。
-
把愈伤组织从诱导培养基中取出,洗净表面培养基后,切成0.5 cm大小后转入不定芽分化培养基。以1/2MS为基本培养基,6-BA和NAA分别为因素的两因素四水平正交试验,设计6-BA浓度为0.1 mg·L–1、0.2 mg·L–1、0.5 mg·L–1、1.0 mg·L–1,NAA浓度为0.02 mg·L–1、0.05 mg·L–1、0.1 mg·L–1、0.2 mg·L–1。
培养40 d后,从每处理中随机取10个愈伤组织分化的芽丛,统计合格芽苗数量,合格芽苗判断标准为:苗高≥1 cm,叶片数≥2,叶片宽≥1 cm,叶片厚实翠绿。
-
剪下合格芽苗后,转入生根培养基。以1/2MS+20 g·L–1蔗糖+0.2 g·L–1 AC为基本培养基,6-BA和IBA分别为因素的两因素四水平正交试验,设计6-BA浓度为0 mg·L–1、0.01 mg·L–1、0.02 mg·L–1、0.05 mg·L–1,IBA浓度为0.1 mg·L–1、0.2 mg·L–1、0.5 mg·L–1、1.0 mg·L–1。
每处理共接种400株,分为4个重复,100株/重复。培养30 d后,统计芽苗的生根情况,合格生根苗判断标准为:苗高≥3 cm,气生根数≥2,气生根长≥1 cm,不定根数≥2,叶片数≥3,叶片厚实翠绿。
-
未做说明时,以上培养基均添加7 g·L–1卡拉胶,蔗糖30 g·L–1,pH 5.8,培养温度25±2 ℃,光照时长12 h·d–1,光照强度为2 000 Lx。
-
采用DPS 16.05进行正交试验方差分析和SNK多重比较,百分数反正弦转换后再行分析。
1.1. 材料来源
1.2. 试验方法
1.2.1. 无菌外植体制备。
1.2.2. 愈伤组织诱导。
1.2.3. 不定芽分化。
1.2.4. 生根培养。
1.2.5. 培养条件。
1.3. 数据分析
-
红掌分蘖芽接入愈伤诱导培养基后10 d,芽基部逐步膨大(见图1A),20 d后基部可见淡黄色愈伤组织(见图1B),或膨大基部愈伤化(见图1C),不同处理的愈伤组织大小和质地各不相同。方差分析结果表明,6-BA和NAA均对愈伤组织的大小有显著影响(见表1)。
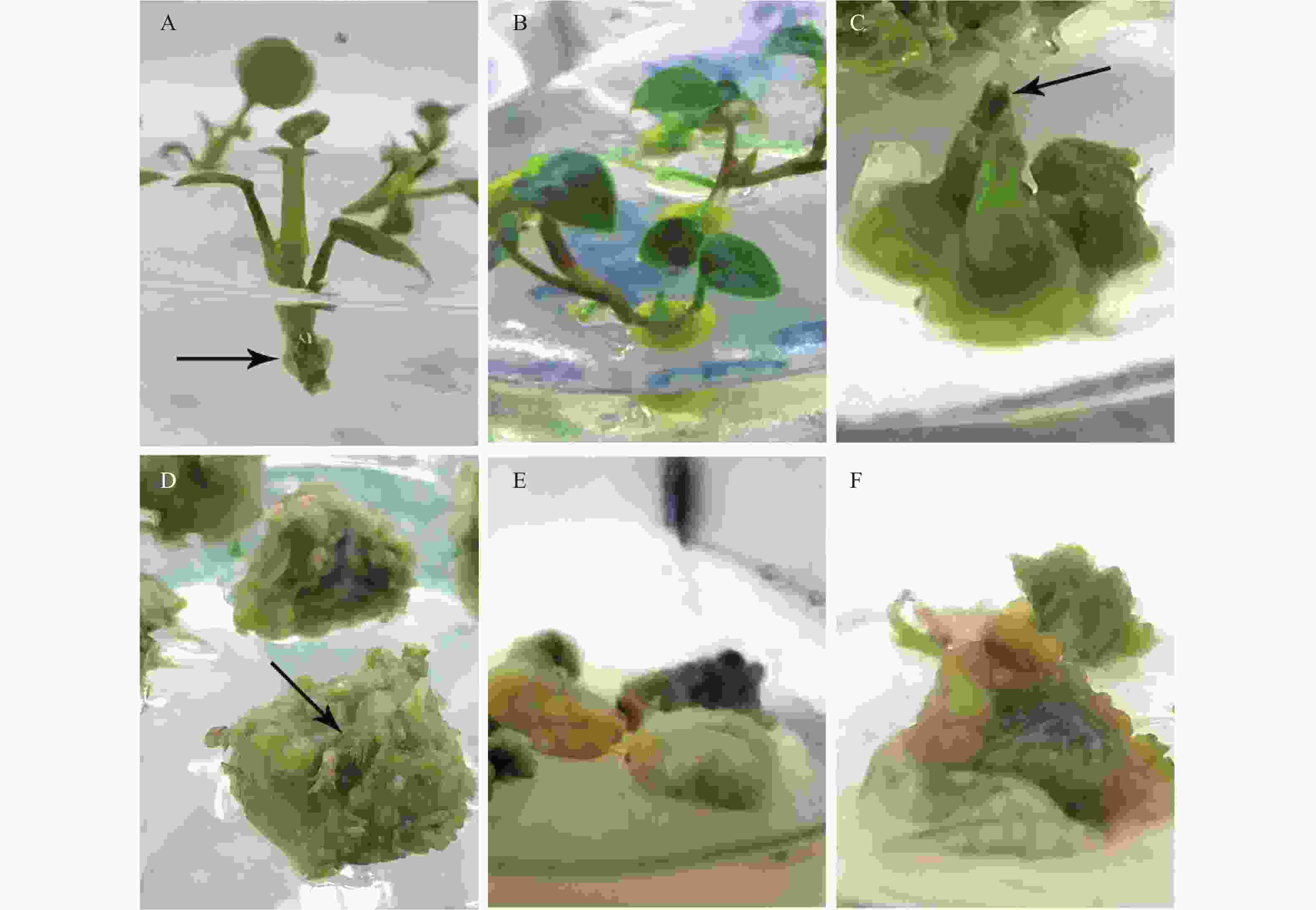
Figure 1. Callus induction of Anthurium andraeanum. A: Explants inoculated for 10 days, the arrow shows the newly callus; B: Bud and the base callus in treatment 3; C: Treatment 7, the apical bud wither and fall, the arrow shows the status of stem; D: Large green callus of treatment 11, the arrow indicates the position of the original apical bud; E: Soft callus of treatment 13; F: Callus formed by explant expansion of treatment 15
变异来源 平方和 自由度 均方 F值 p值 6-BA 10.2488 3 3.4163 138.4972 0 NAA 0.2125 3 0.0708 2.8711 0.0372 误差 5.5253 224 0.0247 总和 17.3396 Table 1. Variance analysis of callus induction of Anthurium andraeanum
进一步的多重比较结果见表2,从中可以发现,愈伤组织直径从0.2~1.4 cm不等,整体来看,6-BA浓度对愈伤组织平均直径的影响最大,浓度越高,愈伤组织平均直径越大,当浓度为0.2 mg/L时,能发现外植体基部有少量愈伤形成,随着6-BA浓度的增加,外植体逐渐经历基部长出大团愈伤、插入培养基部分膨大为愈伤而上部芽苗正常或枯萎、外植体整体愈伤化等阶段。
处理号 6-BA浓度
/(mg·L−1)NAA浓度
/(mg·L−1)平均直径
/cm愈伤状态描述 1 0.2 0.01 0.34e 基部膨大,0.2~0.4 cm,无愈伤组织,芽长高0.5~1倍,叶片正常 2 0.2 0.02 0.27e 基部膨大0.2~0.4 cm,无愈伤组织,芽长高,叶翠绿 3 0.2 0.05 0.39e 小愈伤0.3~0.5 cm,芽长高,叶翠绿 4 0.2 0.1 0.27e 基部膨大,0.2~0.4 cm,芽长高,幼芽基部有根 5 0.5 0.01 0.53d 0.3~0.8 cm愈伤,愈伤软,易碎 6 0.5 0.02 0.6cd 0.3~0.8 cm愈伤,愈伤较软,夹时变形 7 0.5 0.05 0.78b 0.5~1.0 cm大愈伤,愈伤质地硬,原有芽或枯萎,颜色正常 8 0.5 0.1 0.76b 0.5~1.0 cm大愈伤,同时愈伤长根 9 1 0.01 0.72bc 0.5~1.0 cm愈伤,愈伤软,易碎 10 1 0.02 0.75bc 0.8~1.2 cm愈伤,愈伤较软,不好夹 11 1 0.05 0.78b 0.5~1.2 cm大愈伤,不出新芽,原有芽顶端枯萎 12 1 0.1 0.72bc 0.5~1.2 cm大愈伤,愈伤质地硬,同时愈伤长根,原有芽顶端枯萎坏死 13 2 0.01 0.84b 0.5~1.2 cm大愈伤,愈伤较软 14 2 0.02 1.06a 0.7~1.4 cm大愈伤,外植体基部3~5 mm处往上枯萎 15 2 0.05 0.79b 0.5~1.0 cm大愈伤,愈伤化过程中外植体中下部愈伤化,和基部新生愈伤长为一个整体 16 2 0.1 0.83b 外植体愈伤化,形态结构消失 Table 2. Comparison of average diameter and callus state of Anthurium andraeanum under different treatments
NAA浓度对愈伤组织平均直径的影响相对要小,其作用更多的表现在愈伤的状态上,NAA低浓度时,愈伤组织质地软,易变形(处理5、6、9、10、13、14),浓度升高,则愈伤组织容易碎,这种状态非常不利于后续的继代操作(见图1E、F),故这些处理应该摒弃,有的处理,如处理4,则在愈伤和茎干上诱导出了不定根,没有达到愈伤诱导和增殖的效果。
由于愈伤组织的筛选需要根据其分化能力来比较,即需要比较愈伤组织质地、颜色等指标综合考虑,一般0.5 cm以上的愈伤即可满足后期分化的需求,从剩余处理中选愈伤组织呈淡黄色至绿色、质地坚硬的、表面有细小颗粒状突起的处理有:处理3、7、8、11、12,处理3愈伤较小,达不到后期诱导的需求,处理8、11、12诱导的愈伤大小和质地合适,但处理8、12的愈伤会长不定根,处理7、11和12的部分外植体的顶芽会枯萎(见图1C、D),但不影响后续的不定芽再生。结合下一步的试验,发现6-BA浓度越高,不定芽再生数量越多而有效芽减少的现象,为减轻6-BA的积累效应,在愈伤组织诱导阶段,应在保证愈伤组织诱导效果的同时,尽量选择6-BA浓度低的处理。
综上所述,优选处理7(0.5 mg·d–1 6-BA + 0.05 mg·d–1 NAA)为诱导红掌分蘖芽愈伤组织激素组合。
-
红掌愈伤组织转入不定芽分化培养基后10 d,愈伤组织表面可见颗粒状突起,20 d后可见不定芽生成,不定芽高3~5 mm,呈圆柱状,其上方有一片幼叶,待幼叶长至3 mm宽时,第二片叶开始萌发,30 d后长出2~4片叶子,苗高可达2~4 cm,部分芽苗茎段上可见气生根,各处理的平均有效芽数/愈伤介于3.2~6.2个之间。方差分析结果表明,6-BA和NAA均对不定芽的分化效果有显著影响(见表3)。
变异来源 平方和 自由度 均方 F值 p值 6-BA 43.075 3 14.3583 23.711 0 NAA 6.675 3 2.225 3.6743 0.0137 误差 87.2 144 0.6056 总和 162.375 Table 3. Variance analysis of adventitious bud differentiation of Anthurium andraeanum
进一步多重比较结果见表4,从中可以发现,随着6-BA浓度的增加,愈伤组织的分化率不断提高(见图2A),而当提高至1.0 mg·L–1时,平均有效芽数反而降低了,究其原因,并非诱导的不定芽数量少了,而是在整个愈伤的四周,布满了密密麻麻的芽点,过于集中的芽点在长大的过程中相互挤压,抢占养分,导致整体长势差(见图2C),而愈伤组织下部萌发的不定芽(见图2B),甚至会把这个愈伤组织顶离培养基,更加加剧了愈伤组织上面不定芽的黄化或老化。
处理号 6-BA浓度
/(mg·L–1)NAA浓度
/(mg·L–1)平均有效芽数 显著性比较 1 0.1 0.02 3.8 cd 2 0.1 0.05 4 cd 3 0.1 0.1 3.5 d 4 0.1 0.2 4 cd 5 0.2 0.02 5.4 b 6 0.2 0.05 6.2 a 7 0.2 0.1 4.1 cd 8 0.2 0.2 4.6 c 9 0.5 0.02 3.9 cd 10 0.5 0.05 4.1 cd 11 0.5 0.1 3.9 cd 12 0.5 0.2 4.2 cd 13 1.0 0.02 3.9 cd 14 1.0 0.05 3.3 d 15 1.0 0.1 3.9 cd 16 1.0 0.2 4.2 cd Table 4. Comparison of the number of effective adventitious buds of Anthurium andraeanum under different treatments

Figure 2. Callus induction of Anthurium andraeanum. A-C: Adventitious buds of treatment 13; D-E: Adventitious buds of treatment 6; F: Rooting effect of adventitious buds
而NAA在不定芽诱导阶段的表现与愈伤诱导时的表现略有不同,NAA对坚硬的愈伤组织没有软化作用,但其诱导出根的能力依然存在。NAA浓度在0.1 mg·d–1以上时,愈伤组织会长出不定根,挤占了不定芽的空间,影响不定芽的分化;部分不定芽茎段上也会萌发出根,这些不定芽容易畸形或停止生长。
因此,在愈伤组织再生阶段,并非不定芽越多越好,而是根据愈伤组织的大小,合理分布,以一个愈伤组织5~7个芽为宜(见图2D、E),与牛瑞鹤等的研究结论一致[2],既能保证新生不定芽均能长大为芽苗,也能继续维持愈伤组织的状态,在剪去芽苗后,愈伤组织还能继续培养出不定芽,据测算,一个5 mm大小的愈伤组织,能连续培育8~10轮健壮芽苗。
综上所述,从平衡考虑的角度出发,处理6(0.2 mg/L 6-BA+0.05 mg/L NAA)为红掌不定芽分化激素组合。
-
红掌芽苗转入各个处理的生根培养基10 d后,芽苗基部可见有白色突起,表面根原基已经形成,茎段上气生根伸长,气生根上可见白色根毛,20 d后,根原基发育成根,30 d时,跟在培养基内盘旋1~2周,部分根变为绿色(见图2F)。方差分析结果表明,6-BA对芽苗生根影响显著,而IBA对芽苗生根影响不显著(见表5)。
变异来源 平方和 自由度 均方 F值 p值 6-BA 22.8383 3 7.6128 83.6647 0 IBA 0.6926 3 0.2309 2.5374 0.0676 误差 4.3676 48 0.091 总和 28.2997 Table 5. Variance analysis of shoot rooting of Anthurium andraeanum
多重比较结果见表6,从中可以看出,在不添加6-BA,仅有IBA时,红掌生根状态良好,有效苗比例均在85%以上,并且处理2和处理3中新生的气生根较多。而在添加了6-BA以后,芽苗容易畸形,在低浓度的6-BA中(处理5-8),芽苗基部膨大,能长出不定根,但这种苗子在出圃后基部肥大,长势没有处理1-4培育的生根苗好,推测原因是基部膨大后,对芽苗内部的输导组织造成了伤害,影响到了大苗的发育。随着6-BA浓度的增加(处理9-12),芽苗基部出现了愈伤组织,出现了类似于2.1中愈伤组织诱导时的现象,而此时愈伤组织是不需要的,当6-BA浓度继续增加时,更会导致气生根的畸形。
处理号 6-BA浓度/(mg·L–1) IBA浓度/(mg·L–1) 有效苗比率 幼苗状态比较 1 0 0.1 85.75% a 气生根较少 2 0 0.2 93.50% a 气生根较多 3 0 0.5 94.50% a 气生根较多 4 0 1 86.50% a 气生根少,都是不定根 5 0.01 0.1 57.25% bcd 基部膨大,不定根从膨大部位长出,有少量气生根 6 0.01 0.2 66.75% b 基部膨大,不定根从膨大部位长出,有少量气生根 7 0.01 0.5 68.00% b 基部膨大,不定根从膨大部位长出,有少量气生根 8 0.01 1 61.75% bc 基部膨大,不定根从膨大部位长出,有少量气生根 9 0.02 0.1 43.00% d 基部有愈伤,根从愈伤上长出 10 0.02 0.2 52.75% bcd 基部有愈伤,根从愈伤上长出,有气生根 11 0.02 0.5 52.25% bcd 基部有愈伤,根从愈伤上长出,有气生根 12 0.02 1 49.75% cd 基部有愈伤,根从愈伤上长出,有气生根 13 0.05 0.1 48.00% cd 基部有愈伤,有气生根,气生根接触培养基后愈伤化 14 0.05 0.2 49.75% cd 基部有愈伤,有气生根,气生根接触培养基后愈伤化 15 0.05 0.5 45.75% cd 基部有愈伤,有气生根,气生根接触培养基后愈伤化 16 0.05 1 47.50% cd 基部有愈伤,有气生根,气生根接触培养基后愈伤化 Table 6. Comparison of the number of effective adventitious buds of Anthurium andraeanum under different treatments
综上所述,在红掌芽苗生根的阶段,只添加0.2~0.5 mg/L IBA即可达到理想的生根效果。
将生根苗移至薄膜大棚中炼苗,光照控制在2500~5000 lx,温度20~30 ℃,7~10 d后移栽,选用0~10 mm细泥炭+1%珍珠岩。湿度保存70%以上,温度30 ℃以下,15 d左右气根开始生长。
2.1. 红掌愈伤组织诱导
2.2. 红掌不定芽分化
2.3. 红掌芽苗生根
-
本研究以红掌“特仑萨”2—3 cm长的分蘖芽为外植体,在MS+0.5 mg·L–1 6-BA + 0.05 mg·L–1 NAA + 30 g·L–1蔗糖的培养基中培养30 d后,能诱导出直径0.5~1.0 cm、质地坚硬的愈伤组织。愈伤组织在1/2MS+0.2 mg·L–1 6-BA+0.05 mg·L–1 NAA+ 30 g·L–1蔗糖的培养基中40 d后,可平均分化6个有效芽,同时愈伤保持持续分化能力。芽苗转入1/2MS+0.2—0.5 mg·L–1 IBA+20 g·L–1蔗糖的培养基30 d后,可发育为苗高3 cm以上、带有不定根和气生根的生根苗。
外植体的选择是植物组织培养能否成功的首要问题。外植体的分化程度与不定芽和芽苗的实际苗龄直接相关。红掌外植体多采用叶片、叶柄、茎、根、苞片、花轴等,其中以叶、叶柄的报道居多[1-10]。尽管叶片取材和消毒均容易,但叶片外植体的缺陷是其分化程度较高,再生出来的芽苗实际年龄与母株一样,如刘宝骏等利用“粉冠军”“罗宾奴”“冠军”三个品种的叶片和叶柄为外植体,诱导获得了胚性愈伤组织,胚性愈伤组织集中在叶片基部与叶柄相连的位置,而其他部位的诱导效果较差,但愈伤组织诱导率和体胚分化率均不高[4]。原因是供试材料为连续继代超过6年的安祖花组培苗,材料本身已高度驯化,再生能力低下,缺乏胚性细胞,限制了胚性愈伤组织的形成。
本研究选用的红掌分蘖芽,为母株基部萌发,是所有外植体中最为幼化的材料[11],其不足之处是单株产生的分蘖数量少且需要长时间规范化培养大量母株,同时,分蘖与基质接触,表面带菌较多,王晶等利用腋芽为外植体,消毒后接种在含有抗生素的培养基中,有效抑制内生菌的生长[5],但长期培养有隐患。因此,本研究认为多准备母株、大棚标准管理,尽可能提供多的外植体是必要的。同时,本研究愈伤组织来源于分蘖芽茎段内的分生组织,其分生能力天然强于叶肉、根等材料,与大部分红掌愈伤组织形成需要50~60 d相比[2, 12],本研究愈伤组织形成时间缩短一半。
激素配比则是愈伤组织诱导、分化和生根的核心所在[11, 14]。红掌愈伤组织的诱导,2,4-D、NAA等分裂素与6-BA联合使用的效果好,其中2,4-D诱导愈伤组织最快并且量大,在叶片、叶柄愈伤组织的诱导中运用广泛[12, 2, 14]。但2,4-D诱导分蘖芽时,愈伤质地松软,后期愈伤组织器官发生效果差,适宜于诱导胚性愈伤组织[15]。体胚发育中容易出现胚状体的根与芽发育不均衡导致植物形态建成失败[4]。因此,本研究未使用2,4-D,而采用6-BA和NAA的组合诱导愈伤,研究发现,随BA浓度的增大,质地逐渐变紧密、坚硬。随NAA浓度的增加愈伤组织趋于疏松,这与关婧竹[9]对于BA和NAA浓度对愈伤质地的变化趋势是一致的。
由于红掌品种繁多,没有一种配方能满足所有品种的需求,需要根据外植体在培养基中的表现,调整配方,以使外植体向目标方向发育。付娜对三种红掌的再生进行了研究,6-BA最佳浓度从0.2~1.0 mg/L不等,浓度差5倍[3]。培养基中其他成分也对红掌组培有重要作用,辛伟杰采用蔗糖和葡萄糖混搭的方法,诱导出了体胚[16]。本研究也发现培养基中氮含量、活性炭含量均能影响不定芽分化或不定芽的生长(篇幅所限没有进行分析)。
本研究建立了红掌“特仑萨”的分蘖芽诱导愈伤组织和再生技术体系,为下一步利用愈伤组织开展遗传转化体系研究奠定了材料基础[17, 18]。



















 DownLoad:
DownLoad:
