-
榆叶梅(Prunus triloba)是山西省重要的园林植物,城市园林中常常独立造景或者与连翘、迎春、紫叶李等混合栽培,在太原市众多城市广场形成了优美的城市园林景观,深受广大市民的喜爱[1]。城市环境下由于汽车尾气、化学材料、各种垃圾污染和冬季融雪剂的应用等原因均会造成土壤不同程度的盐碱化,加上山西省降水不足,蒸发量大等原因,土壤次生盐渍化现象较为普遍,这对城市园林绿化中栽植的榆叶梅会产生较大影响,特别是1-3年生的幼苗,常常发生叶片黄化,植株生长不良甚至死亡的现象[2]。苗期是植物耐盐性最弱的时期,通过外源物质提高榆叶梅幼苗抗盐能力促进苗木正常生长,这对培育优质壮苗具有重要的实践意义。钙是植物必需的营养元素之一,也是偶联外界环境与植物细胞内生理生化反应的第二信使,对调节植物在盐胁迫环境下的适应性具有重要作用[3]。盐胁迫引起植物细胞内钙离子积累,然后由钙解码器通过调节蛋白质的磷酸化和去磷酸化产生钙信号,从而激活下游离子通道和调节相关基因表达并引起生理生化变化以应对盐胁迫的危害[4];另外,钙离子的积累会提高植物渗透调节能力,以应对盐胁迫引起的吸水困难[5],并且盐胁迫下钙还会使膜上蛋白质羧基与磷酸酯结合,提高膜的稳定性,有效降低盐胁迫的危害[6];钙离子还通过与钙调蛋白结合形成复合体,以此激活下游目标基因,提高植物对盐胁迫的耐受性[7]。陈利全[8]研究结果表明15 mmol·L−1的氯化钙可以较好地缓解盐胁迫对木麻黄的危害并显著提高幼苗存活率;滕梦鑫[9]研究认为10 mmol·L−1氯化钙通过显著提高植株POD活性和游离脯氨酸含量来有效缓解盐胁迫对巴西蕉的危害;闫振[10]研究认为10 mmol·L−1的氯化钙会显著提高蔷薇抗氧化酶活性和叶绿素含量,增强光合能力来促进幼苗生长;邸桂俐[11]研究认为3 mmol·L−1的Ca2+可以显著降低玉米幼苗抗氧化酶活性和丙二醛、脯氨酸、可溶性蛋白含量,有效缓解了盐胁迫对玉米幼苗的危害;赵英[12]研究认为6 mmol·L−1的氯化钙对缓解罗汉果幼苗盐胁迫效应显著优于2 mmol·L−1和14 mmol·L−1处理。从前人相关研究来看,氯化钙主要通过调节植物抗氧化酶活性、叶绿素含量及光合作用来提高抗盐性,但是氯化钙对盐胁迫的缓解效应因植物种类不同使用浓度也存在差异。盐胁迫会导致榆叶梅幼苗叶片黄化和生长不良,外源氯化钙是否能缓解这一问题以及适宜的处理浓度目前仍然不清楚,特别是钙对盐胁迫下榆叶梅能量代谢机理仍然有待于揭示。通过研究不同浓度氯化钙对盐胁迫下榆叶梅幼苗生理特性的影响规律,从光合和蔗糖代谢角度分析外源钙缓解榆叶梅盐胁迫的生理机制,以期为其盐渍下栽培和科学应用外源钙元素提高抗盐性提供理论依据。
-
试验于在黑茶山国有林管理局附属苗圃玻璃温室中进行。2022年5月20日,选取生长一致,株高为10 cm左右的当年生榆叶梅幼苗,将其移栽至长×宽×高=30×25×25 cm的塑料栽植盆内,然后将其搬迁至玻璃温室中,温室温度白天为30℃,晚上为22℃,相对湿度65%±5%。培育该实生苗育苗所用种子于2021年采集于苗圃母树林,去掉果皮后采用层积沙藏的方式越冬,2021年3月将贮藏种子取出,然后在苗圃中点播方式繁殖实生苗,5月20日移栽至试验所用塑料栽植盆中。栽植盆内培养土配置比例为:珍珠岩:苗圃表层土:充分腐熟有机肥=2:1:1充分混合而成。每个栽植盆栽培一株榆叶梅幼苗,缓苗期通过称重法控制土壤含水量保持在田间持水量的65%±5%,2022年6月20日缓苗结束后进行盐胁迫和氯化钙处理。
-
试验盐胁迫浓度设置结合黑茶山国有林管理局盐碱土含盐量现状,同时参考刘佳[13]报道,设置氯化钠浓度为0.4%。本试验共设置5个处理,其中T1为对照,无盐胁迫和氯化钙处理,T2~T5为盐胁迫和氯化钙处理,各处理氯化钠和氯化钙浓度见表1。6月20日,配置好NaCl和氯化钙溶液后,按照试验设计分别浇入塑料栽植盆中。6月20日下午18:00,T2~T5每盆浇灌氯化钠溶液1500 mL,T1处理浇灌等量的清水,同时T3~T5分两次浇入试验设计相应浓度的氯化钙溶液1000 mL。每个栽植盆底部均放置一个盆拖,用于收集浇水后的渗漏液,收集完成后及时浇灌入栽植盆中,以使栽植盆内的盐浓度保持相对稳定。每个处理12盆,共计60盆,随机排列。整个试验期间,采用称重法维持土壤含水量为田间持水量的65%~75%之间。
表 1 各处理氯化钠和氯化钙浓度
Table 1. Concentration of sodium chloride and calcium chloride in each treatment
处理
Treatment氯化钠
Sodium chloride氯化钙
Calcium chlorideT1 0 0 T2 0.4% 0 T3 0.4% 5 mmol·L−1 T4 0.4% 10 mmol·L−1 T5 0.4% 15 mmol·L−1 -
分别于处理后20 d、40 d、60 d和80 d收集各处理的榆叶梅叶片。每个处理选择3株植株,随机选择2个枝条,摘取从枝条顶端向下数第3~6片叶,然后带回实验室用于生理指标的测定。在叶片取样的同时,使用Li-6400便携式光合仪测定榆叶梅光合作用;叶绿素含量测定采用浸提法[14],SOD活性采用NBT还原法[15],POD活性采用愈创木酚法[15],蔗糖磷酸合酶(SPS)、蔗糖合成酶(SuSy)活性测定采用间苯二酚法[16]。
-
图表制作使用Excel2010版软件,方差分析使用DPS7.05版软件。
-
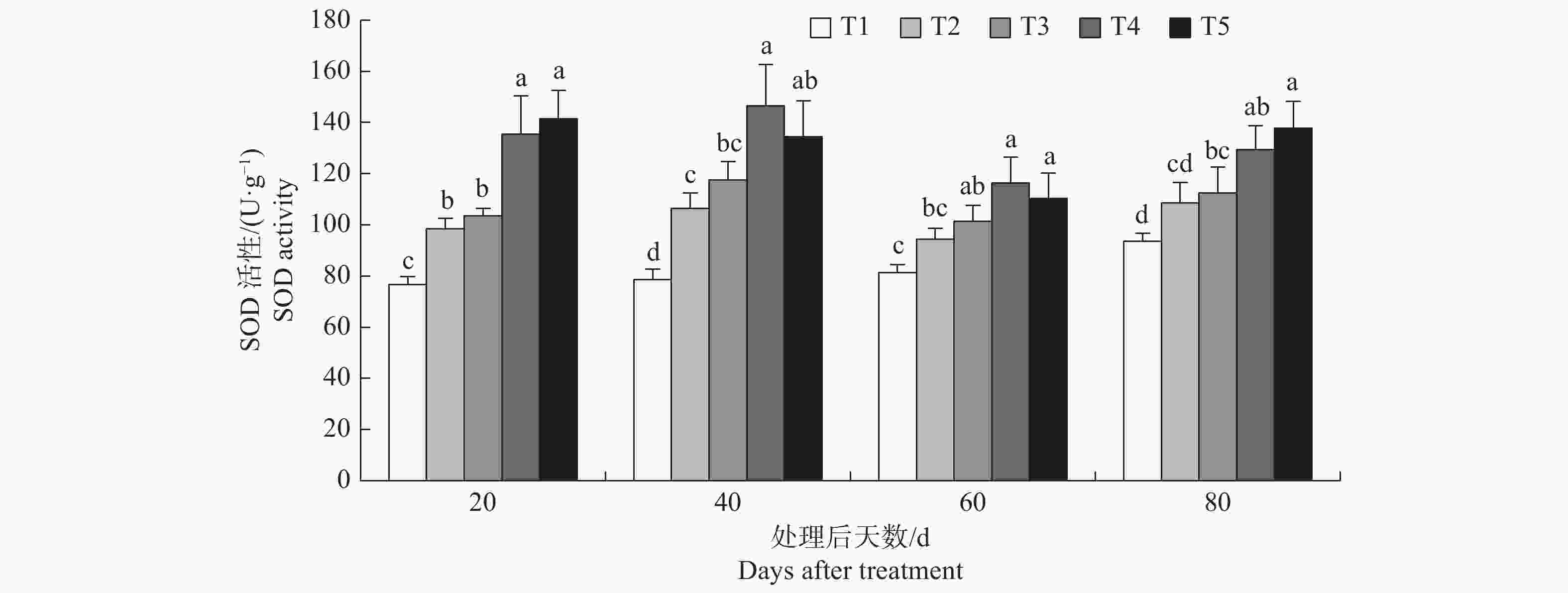
方差分析结果显示p值均小于0.01(见表2),表明不同处理对榆叶梅幼苗SOD活性的影响存在显著差异。由图1可知,T2与T1相比提高了榆叶梅SOD活性,表明氯化钠处理会引起榆叶梅幼苗SOD活性升高;T3、T4、T5与T2相比提高了榆叶梅幼苗SOD活性,其中T3与T2相比整个试验期间SOD活性分别提高了5.05%、10.50%、7.42%、3.64%,无显著差异,表明5 mmol·L−1的氯化钙不会对盐胁迫下榆叶梅SOD活性产生显著影响;T4在整个试验期间均显著高于T2,处理后20d和40d T4显著高于T3,表明氯化钙浓度从5mmol·L−1提高至10在20d和40d会显著提高盐胁迫下榆叶梅SOD活性;T4显著高于T2,T4与T3之间无显著差异,表明氯化钙浓度从10 mmol·L−1提高至15 mmol·L−1并未显著提高榆叶梅幼苗SOD活性。
表 2 榆叶梅SOD活性方差分析统计表
Table 2. Statistics of variance analysis of SOD activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 8748.949 4 2187.237 23.026 0.0002 误 差 Deviation 759.910 8 94.989 - - 总变异 Total variance 9510.273 14 - - - 40d 处理间 Among treatment 8299.787 4 2074.947 14.808 0.001 误 差 Deviation 1120.975 8 140.122 - - 总变异 Total variance 9425.368 14 - - - 60d 处理间 Among treatment 2251.561 4 562.890 8.711 0.005 误 差 Deviation 516.929 8 64.616 - - 总变异 Total variance 2778.525 14 - - - 80d 处理间 Among treatment 3679.385 4 919.846 10.124 0.003 误 差 Deviation 726.895 8 90.862 - - 总变异 Total variance 4422.753 14 - - - -
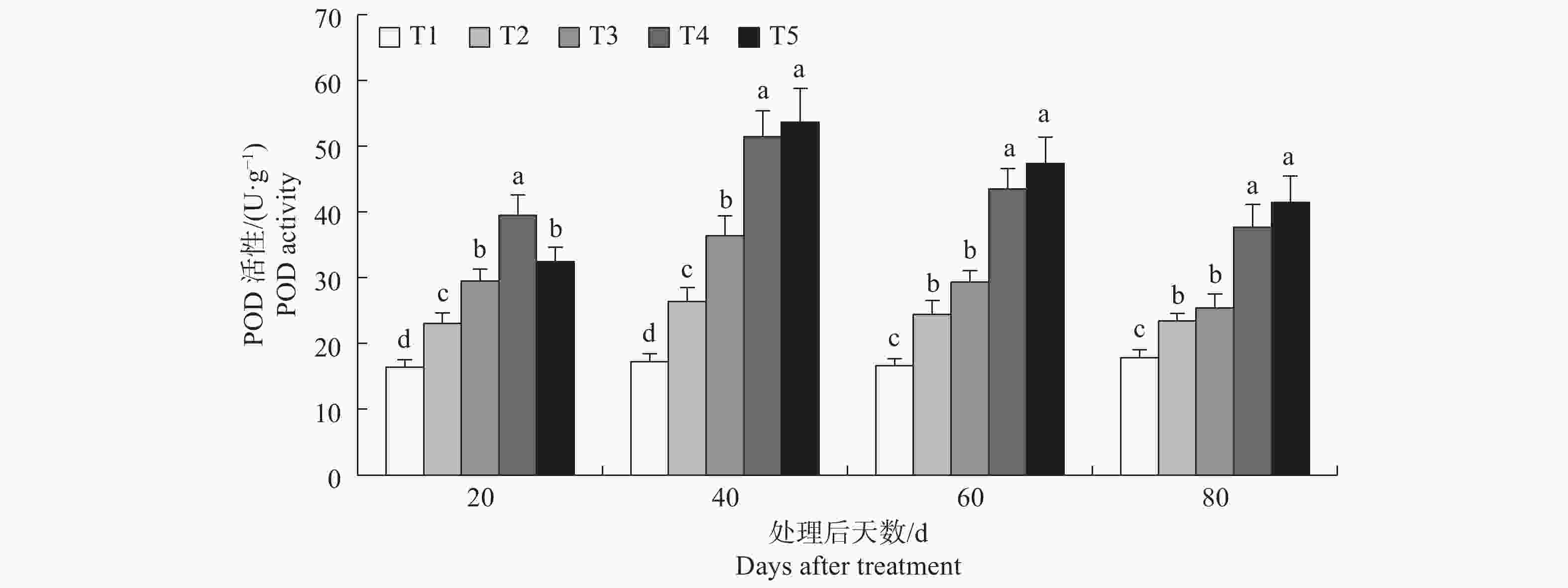
方差分析结果表明p值均小于0.01(见表3),表明不同处理之间存在显著差异。由图2可知,第20 d至80 d,T2与T1相比POD均显著提高了,表明该浓度的盐胁迫对榆叶梅产生了明显的胁迫效应。处理后20 d和40 d,POD活性T3 分别比T2提高了27.96%和37.99%,差异显著,处理后60 d和80 d,T3与T2之间无显著差异;T4与T2相比POD活性分别提高了71.34%、95.08%、78.07%、60.84%,差异显著,表明外源添加10 mmol·L−1的氯化钙可以显著提高盐胁迫下榆叶梅幼苗POD活性;T4显著高于T3,表明氯化钙浓度从5 mmol·L−1提高至10 mmol·L−1也会显著提高POD活性;处理后20 dT5显著低于T4,处理后40 d至80 d,T5与T4之间无显著差异。
表 3 榆叶梅幼苗POD活性方差分析统计表
Table 3. Statistics of variance analysis of POD activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 936.602 4 234.150 43.088 0.0001 误 差 Deviation 43.474 8 5.434 - - 总变异 Total variance 980.224 14 - - - 40d 处理间 Among treatment 3271.088 4 817.772 59.080 0.0001 误 差 Deviation 110.734 8 13.842 - - 总变异 Total variance 3386.165 14 - - - 60d 处理间 Among treatment 2324.166 4 581.042 69.002 0.0001 误 差 Deviation 67.365 8 8.421 - - 总变异 Total variance 2392.692 14 - - - 80d 处理间 Among treatment 1272.989 4 318.247 37.169 0.0001 误 差 Deviation 68.497 8 8.562 - - 总变异 Total variance 1344.384 14 - - - -
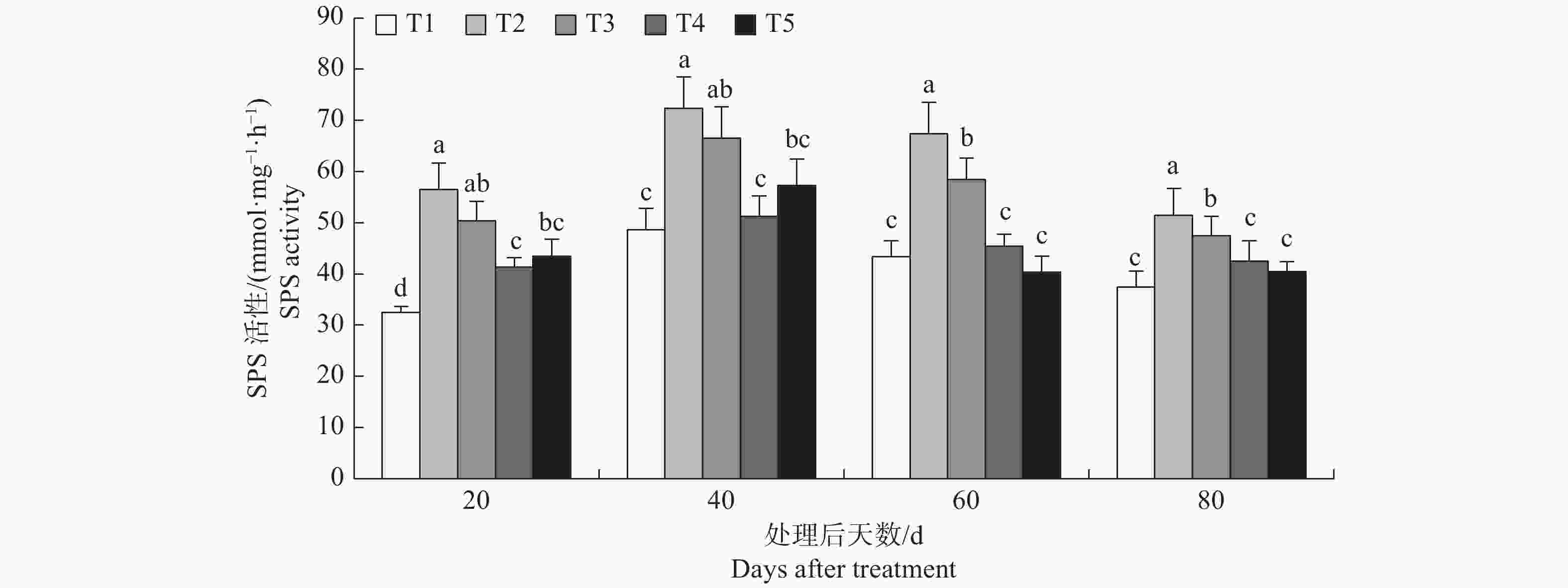
由表4可知,方差分析结果表明p值均小于0.01,表明各处理之间存在显著差异。由图3可知,T2与T1相比榆叶梅幼苗SPS活性分别提高了74.05%、48.93%、55.30%、37.46%,差异显著,表明该浓度的盐胁迫显著提高榆叶梅了SPS活性。外源氯化钙降低了盐胁迫下榆叶梅SPS活性,处理后20 d和40 d T3与T2之间无显著差异,处理后60 d和80 d两个处理之间差异显著;整个试验期间T4与T2相比SPS分别降低了26.89%、29.23%、32.60%、17.38%,差异显著,表明10 mmol·L−1的氯化钙显著降低了盐胁迫下榆叶梅幼苗的SPS活性;处理后20 d 至80 d,T4均显著低于T3,表明氯化钙浓度从5 mmol·L−1提高至10 mmol·L−1会显著降低盐胁迫下榆叶梅SPS活性;T5显著低于T2,T5与T4之间无显著差异。
表 4 榆叶梅幼苗SPS活性方差分析统计表
Table 4. Statistics of variance analysis of SPS activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 1002.304 4 250.576 17.705 0.0005 误 差 Deviation 113.225 8 14.153 - - 总变异 Total variance 1116.190 14 - - - 40d 处理间 Among treatment 1221.491 4 305.373 9.463 0.0040 误 差 Deviation 258.150 8 32.269 - - 总变异 Total variance 1491.197 14 - - - 60d 处理间 Among treatment 1583.039 4 395.760 20.616 0.0003 误 差 Deviation 153.572 8 19.197 - - 总变异 Total variance 1743.871 14 - - - 80d 处理间 Among treatment 377.323 4 94.331 64.399 0.0001 误 差 Deviation 11.718 8 1.465 - - 总变异 Total variance 521.280 14 - - - -
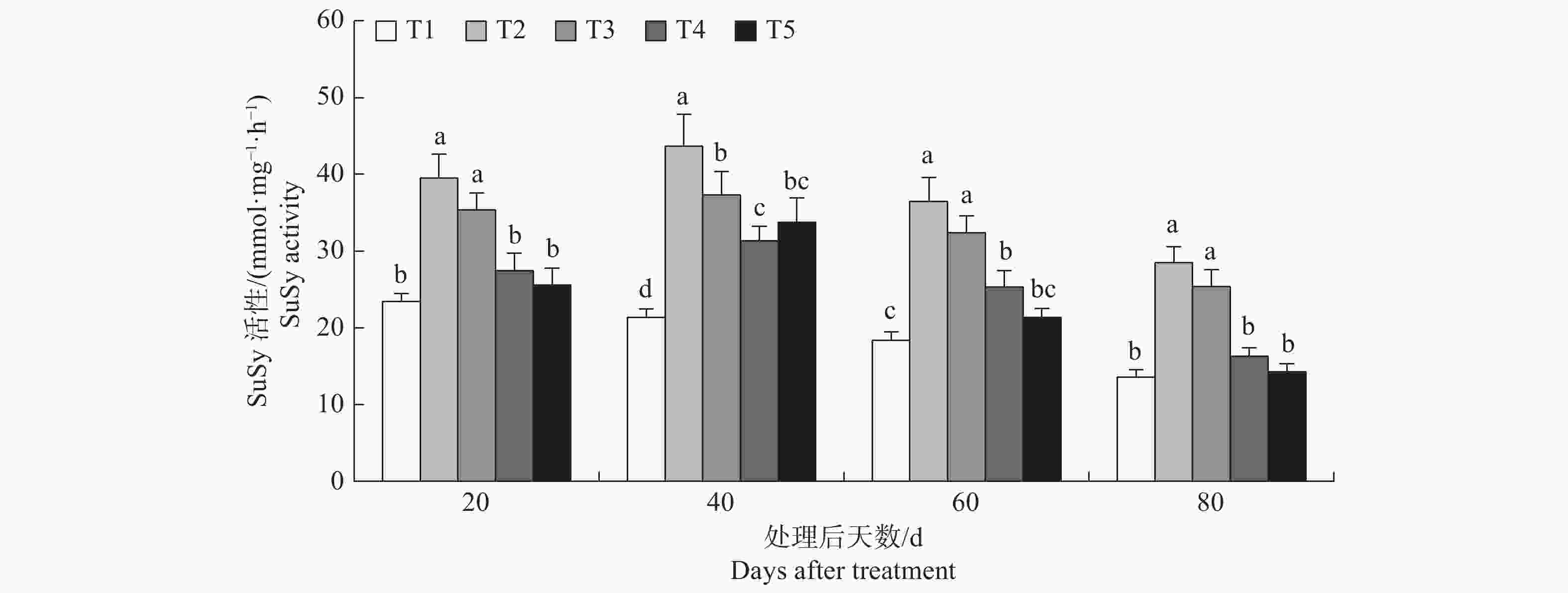
方差分析结果p值均小于0.01(见表5),表明不同处理之间存在显著差异。由图4可知,处理后20 d至80 d T2与T1相比SuSy活性分别提高了68.77%、104.46%、98.78%、110.28%,表明该浓度盐胁迫会显著提高榆叶梅幼苗SuSy活性。处理后20 d、60 d和80 d T3 SuSy活性低于T2但无显著差异,处理后40 d T3显著低于T2;T4与T2相比在整个试验期间均显著降低了SuSy活性,说明10 mmol·L−1的氯化钙对降低盐胁迫下榆叶梅SuSy活性优于5 mmol·L−1;T5与T2相比SuSy活性分别降低了35.31%、22.73%、41.54%、49.88%,差异显著,表明15 mmol·L−1的氯化钙也会显著降低盐胁迫下榆叶梅SuSy活性;同时, 10 mmol·L−1和15 mmol·L−1的氯化钙对盐胁迫下榆叶梅SuSy活性的影响处于同一水平。
表 5 榆叶梅幼苗SuSy活性方差分析统计表
Table 5. Statistics of variance analysis of SuSy activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 565.473 4 141.368 21.721 0.0002 误 差 Deviation 52.067 8 6.508 - - 总变异 Total variance 617.610 14 - - - 40d 处理间 Among treatment 810.743 4 202.686 20.050 0.0003 误 差 Deviation 80.871 8 10.109 - - 总变异 Total variance 892.301 14 - - - 60d 处理间 Among treatment 684.940 4 171.235 31.555 0.0001 误 差 Deviation 43.413 8 5.427 - - 总变异 Total variance 728.613 14 - - - 80d 处理间 Among treatment 565.938 4 141.485 45.952 0.0001 误 差 Deviation 24.632 8 3.079 - - 总变异 Total variance 591.041 14 - - - -
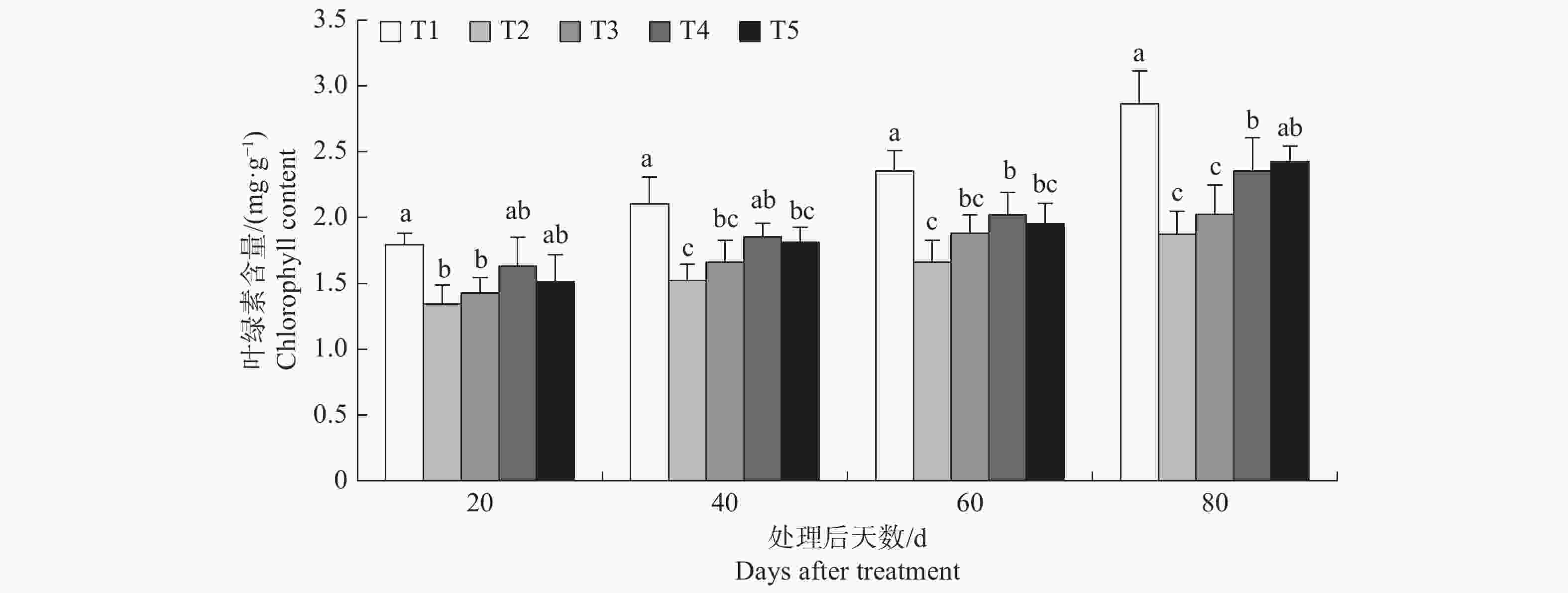
榆叶梅叶绿素含量方差分析结中p值均小于0.05,表明不同处理之间存在显著差异;由图5可知,随着处理时间增加,T2与T1相比榆叶梅叶绿素含量分别降低了25.23%、27.58%、29.32%、34.58%,差异显著,表明本试验所设置盐浓度会显著降低榆叶梅叶片内叶绿素含量。外源氯化钙会提高盐胁迫下榆叶梅叶绿素含量,处理后20 d至60 d T3与T2相比叶绿素含量分别提高了6.20%、9.19%、13.02%、8.01%,无显著差异,处理后40 d至80dT4显著高于T2,T5仅在处理后80d显著高于T2,表明10 mmol·L−1的氯化钙对提高盐胁迫下榆叶梅幼苗叶绿素含量效果优于5 mmol·L−1和10 mmol·L−1。
表 6 榆叶梅叶绿素方差分析统计表
Table 6. Statistics of variance analysis of chlorophyll content in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 0.378 4 0.095 2.912 0.093 误 差 Deviation 0.260 8 0.033 - - 总变异 Total variance 0.640 14 - - - 40d 处理间 Among treatment 0.571 4 0.143 5.510 0.020 误 差 Deviation 0.207 8 0.026 - - 总变异 Total variance 0.787 14 - - - 60d 处理间 Among treatment 0.755 4 0.189 6.235 0.014 误 差 Deviation 0.242 8 0.030 - - 总变异 Total variance 1.003 14 - - - 80d 处理间 Among treatment 1.784 4 0.446 8.204 0.006 误 差 Deviation 0.435 8 0.054 - - 总变异 Total variance 2.229 14 - - - -
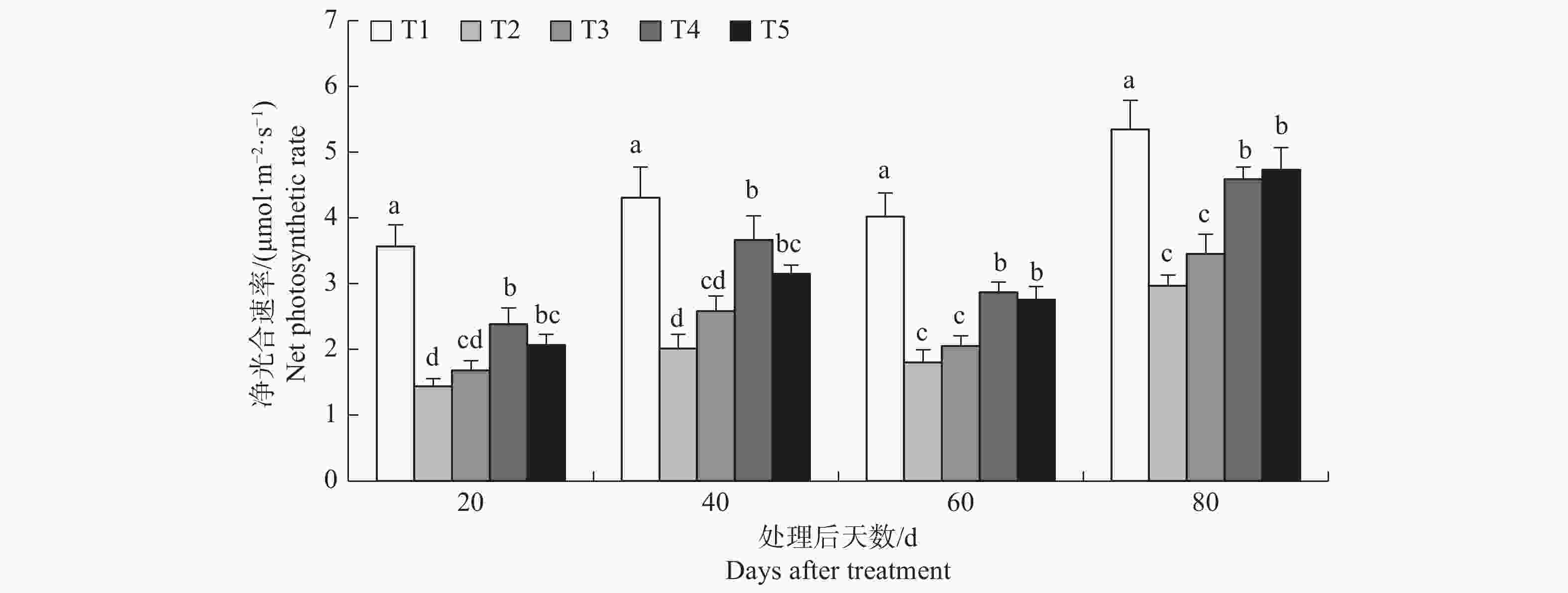
榆叶梅净光合速率处理后20d至80d方差分析结果p值均小于0.01,表明不同处理的净光合速率存在显著差异。由图6可知,盐胁迫降低了榆叶梅净光合速率,外源添加氯化钙提高了榆叶梅净光合速率,整个试验期间T4与T2相比净光合速率分别提高了66.28%、81.95%、59.55%、54.67%,差异显著,表明10 mmol·L−1的外源氯化钙可以显著提高盐胁迫下榆叶梅幼苗净光合速率;T3与T2相比净光合速率分别提高了17.44%、28.31%、14.29%、16.54%,无显著差异,表明5 mmol·L−1的外源氯化钙不能显著提高盐胁迫下榆叶梅净光合速率;处理后20 d至80 d,T5显著高于T2,T5与T4之间无显著差异。
表 7 榆叶梅净光合速率方差分析统计表
Table 7. Statistics of variance analysis of photosynthetic rate in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 8.261 4 2.065 37.854 0.0001 误 差 Deviation 0.437 8 0.055 - - 总变异 Total variance 8.726 14 - - - 40d 处理间 Among treatment 9.643 4 2.411 21.469 0.0002 误 差 Deviation 0.898 8 0.112 - - 总变异 Total variance 10.564 14 - - - 60d 处理间 Among treatment 8.996 4 2.249 38.557 0.0001 误 差 Deviation 0.467 8 0.058 - - 总变异 Total variance 9.518 14 - - - 80d 处理间 Among treatment 11.473 4 2.868 32.301 0.0001 误 差 Deviation 0.710 8 0.089 - - 总变异 Total variance 12.396 14 - - - -
盐胁迫会造成植物体内积累大量的活性氧,从而破坏植物膜系统,引起生理代谢障碍并影响植物正常生长[17]。SOD和POD是植物体内清除活性氧的两种重要保护酶,其活性的升高有利于提高植物清除活性氧能力,降低盐胁迫对植物的危害[18]。本试验结果表明,盐胁迫显著提高了两种保护酶活性,这与郭亚宁[19]的研究结果相似。钙是连接植物细胞外信号和细胞内生理反应的第二信号物质,适宜浓度的钙供应可以提高逆境胁迫下植物保护酶活性,从而增强植物抵抗不利环境胁迫的能力[12]。本试验结果显示,外源钙提高了盐胁迫榆叶梅幼苗SOD和POD活性,这可能与钙是感应植物盐胁迫下的信号物质有关,也可能与外源钙会抑制植物细胞内K+流出,减少Na+进入细胞数量,从而有效缓解了盐胁迫的危害有关[20];从不同浓度氯化钙对盐胁迫下榆叶梅SOD和POD活性的影响来看,10 mmol·L−1和15 mmol·L−1的氯化钙处理的两种保护酶活性均显著高于盐胁迫处理,但5 mmol·L−1氯化钙处理在60d后对提高盐胁迫下榆叶梅SOD、POD活性效果不显著,表明10~15 mmol·L−1的氯化钙对提高盐胁迫下榆叶梅SOD和POD活性效果优于5 mmol·L−1处理。
叶绿素是植物进行光合作用的主要色素,其含量的高低直接影响植物净光合速率,从而会影响植物生长发育[21]。本试验结果显示,盐胁迫降低了榆叶梅叶片内叶绿素含量,这与郭亚宁[19]的研究结果一致,赵英[20]研究认为这可能与盐胁迫会降低植物光能捕获和电子传递能力有关,也可能与盐胁迫会引起叶绿素分解有关;外源钙提高了盐胁迫下榆叶梅叶绿素含量,这可能与钙提高了榆叶梅SOD、POD活性,缓解了活性氧对膜系统的危害,减少了叶绿素的分解有关。不同浓度的外源钙对盐胁迫下榆叶梅叶绿素含量的影响不同,第20d至60d,氯化钙浓度从10 mmol·L−1提高至15 mmol·L−1降低了叶绿素含量,这与刘丽[22]的研究结果相似,说明10 mmol·L−1的氯化钙处理相较于15 mmol·L−1处理更有利于提高盐胁迫下榆叶梅叶绿素含量。
盐胁迫导致植物体内积累大量的活性氧除引起膜脂过氧化反应外,还会对光合系统产生伤害,从而显著降低植物净光合速率[23]。研究结果中盐胁迫降低了榆叶梅净光合速率,这可能与盐胁迫导致活性氧在榆叶梅叶片内积累量超过SOD、POD清除能力有关;外源钙提高了盐胁迫下植物净光合速率,这与张雪微[24]的研究结果相似,分析原因认为除了外源钙能够提高榆叶梅膜系统的稳定性有关外[25],还与钙离子作为调控植物气孔开闭的信使有关,因为适宜浓度的钙离子可以调控盐胁迫下植物气孔开放程度,从而会对净光合速率产生显著影响[26]。另外,不同浓度的外源氯化钙处理比较来看,15 mmol·L−1与10 mmol·L−1处理相比在处理后20 d至60 d降低了榆叶梅净光合速率,因此10 mmol·L−1的氯化钙更有利于缓解榆叶梅盐胁迫并提高净光合速率。
盐胁迫会抑制植物光合作用进行的同时,也会影响植物碳代谢过程,从而引起糖类在植物叶片内积累并抑制光合作用的进行[27]。蔗糖是植物光合作用过程中产生的重要碳水化合物,也是植物适应环境的信号物质[28]。SPS和SuSy是植物蔗糖代谢过程中非常重要的两种酶,盐胁迫会导致编码SPS和SuSy的相关基因表达上调,从而使得其活性显著升高,促进蔗糖的合成和提高植物叶片内可溶性糖含量,以缓解盐胁迫对植物的危害[29],这是植物对盐胁迫的重要响应机制,也是盐胁迫提高植物可溶性糖含量的原因[30]。外源钙降低了Na+在细胞内的积累量[20],缓解了盐胁迫对植物的危害,此时钙作为信号物质会调控SPS和SuSy活性降低[31],减少碳水化合物在叶片内的积累,促进蔗糖向葡萄糖和果糖的转化[4],从而降低叶片内可溶性糖含量,降低光合产物在叶片中积累对光合作用的负反馈,有利于提高植物光合速率,促进植物生长。研究结果中10 mmol·L−1的氯化钙降低了盐胁迫下榆叶梅叶片内SPS和SuSy活性,从而避免了糖类在叶片内的积累,这也可能是外源钙能够提高榆叶梅净光合速率的原因之一。
Effects of exogenous calcium on physiological characteristics of Prunus triloba Lindl. seedlings under salt stress
More Information-
摘要: 以当年生榆叶梅幼苗为试验材料,研究了不同浓度氯化钙(5、10、15 mmol·L−1)对盐胁迫(0.4%浓度氯化钠)条件下榆叶梅幼苗生理特性的影响。结果表明:盐胁迫提高了榆叶梅幼苗SOD、POD活性,10 mmol·L−1的氯化钙能够显著提高盐胁迫下两种保护酶活性,15 mmol·L−1与10 mmol·L−1处理之间无显著差异;盐胁迫降低了榆叶梅幼苗叶绿素含量,5 mmol·L−1的氯化钙不会对盐胁迫下榆叶梅幼苗叶绿素含量产生显著影响,10 mmol·L−1处理可显著提高盐胁迫下榆叶梅幼苗叶绿素含量;10 mmol·L−1和15 mmol·L−1的氯化钙均可以显著提高盐胁迫下榆叶梅幼苗净光合速率,5 mmol·L−1处理对盐胁迫下榆叶梅幼苗净光合速率没有显著影响;盐胁迫提高了榆叶梅幼苗叶片内蔗糖磷酸合酶和蔗糖合成酶活性,10 mmol·L−1氯化钙会显著降低盐胁迫下榆叶梅幼苗两种酶活性。综合分析认为,10 mmol·L−1是缓解榆叶梅幼苗盐胁迫的适宜氯化钙浓度。Abstract: The effects of different concentrations of calcium chloride (5, 10, 15 mmol·L−1) on the physiological characteristics of Prunus triloba seedlings under salt stress (0.4% sodium chloride) were studied with P. triloba Lindl. current year seedlings as experimental materials. The results showed that: (1) The SOD and POD activities in P. triloba seedlings were increased under salt stress, and the activities of this two protective enzymes were significantly increased in 10 mmol·L−1 calcium chloride treatment under salt stress, and the 15 mmol·L−1 and 10 mmol·L−1 treatments had no significant difference. (2) The chlorophyll content of P. triloba seedlings was decreased under salt stress, and 5 mmol·L−1 calcium chloride treatment did not significantly affected the chlorophyll content of P. triloba seedlings under salt stress, but 10 mmol·L−1 treatment significantly increased the chlorophyll content of P. triloba seedlings under salt stress. (3) Both 10mmol·L−1 and 15 mmol·L−1 calcium chloride treatment could significantly increase the net photosynthetic rate of P. triloba seedlings, but 5 mmol·L−1 treatment had no significant effect on the net photosynthetic rate of P. triloba seedlings under salt stress; (4) The activities of sucrose phosphate synthase and sucrose synthase in P. triloba seedlings leaves were increased under salt stress, but the activities of this two enzymes in P. triloba seedlings were significantly reduced in 10 mmol·L−1 calcium chloride treatment under salt stress. According to comprehensive analysis, 10 mmol·L−1 was the suitable concentration of calcium chloride to alleviate salt stress of P. triloba seedlings.
-
Key words:
- Prunus triloba;
- salt stress;
- net photosynthetic rate;
- chlorophyll;
- protective enzyme
-
图 1 榆叶梅幼苗SOD活性变化
注:T1为无盐胁迫和氯化钙处理,T2为盐胁迫+ 0 mmol·L−1氯化钙,T3为盐胁迫+5 mmol·L−1氯化钙,T4为盐胁迫+10 mmol·L−1氯化钙,T5为盐胁迫+15 mmol·L−1氯化钙;图中不同小写字母表示不同处理之间差异显著(p<0.05),下同。
Fig. 1 Changes of SOD activity in P. triloba seedlings
Note: T1 represents salt free stress and calcium chloride treatment, T2 represents salt stress+0 mmol · L−1 calcium chloride, T3 represents salt stress+5 mmol · L−1 calcium chloride, T4 represents salt stress+10 mmol · L−1 calcium chloride, T5 represents salt stress+15 mmol · L−1 calcium chloride; The different lowercase letters in the figure indicate significant differences between different treatments (p<0.05), the same as below.
表 1 各处理氯化钠和氯化钙浓度
Tab. 1 Concentration of sodium chloride and calcium chloride in each treatment
处理
Treatment氯化钠
Sodium chloride氯化钙
Calcium chlorideT1 0 0 T2 0.4% 0 T3 0.4% 5 mmol·L−1 T4 0.4% 10 mmol·L−1 T5 0.4% 15 mmol·L−1 表 2 榆叶梅SOD活性方差分析统计表
Tab. 2 Statistics of variance analysis of SOD activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 8748.949 4 2187.237 23.026 0.0002 误 差 Deviation 759.910 8 94.989 - - 总变异 Total variance 9510.273 14 - - - 40d 处理间 Among treatment 8299.787 4 2074.947 14.808 0.001 误 差 Deviation 1120.975 8 140.122 - - 总变异 Total variance 9425.368 14 - - - 60d 处理间 Among treatment 2251.561 4 562.890 8.711 0.005 误 差 Deviation 516.929 8 64.616 - - 总变异 Total variance 2778.525 14 - - - 80d 处理间 Among treatment 3679.385 4 919.846 10.124 0.003 误 差 Deviation 726.895 8 90.862 - - 总变异 Total variance 4422.753 14 - - - 表 3 榆叶梅幼苗POD活性方差分析统计表
Tab. 3 Statistics of variance analysis of POD activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 936.602 4 234.150 43.088 0.0001 误 差 Deviation 43.474 8 5.434 - - 总变异 Total variance 980.224 14 - - - 40d 处理间 Among treatment 3271.088 4 817.772 59.080 0.0001 误 差 Deviation 110.734 8 13.842 - - 总变异 Total variance 3386.165 14 - - - 60d 处理间 Among treatment 2324.166 4 581.042 69.002 0.0001 误 差 Deviation 67.365 8 8.421 - - 总变异 Total variance 2392.692 14 - - - 80d 处理间 Among treatment 1272.989 4 318.247 37.169 0.0001 误 差 Deviation 68.497 8 8.562 - - 总变异 Total variance 1344.384 14 - - - 表 4 榆叶梅幼苗SPS活性方差分析统计表
Tab. 4 Statistics of variance analysis of SPS activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 1002.304 4 250.576 17.705 0.0005 误 差 Deviation 113.225 8 14.153 - - 总变异 Total variance 1116.190 14 - - - 40d 处理间 Among treatment 1221.491 4 305.373 9.463 0.0040 误 差 Deviation 258.150 8 32.269 - - 总变异 Total variance 1491.197 14 - - - 60d 处理间 Among treatment 1583.039 4 395.760 20.616 0.0003 误 差 Deviation 153.572 8 19.197 - - 总变异 Total variance 1743.871 14 - - - 80d 处理间 Among treatment 377.323 4 94.331 64.399 0.0001 误 差 Deviation 11.718 8 1.465 - - 总变异 Total variance 521.280 14 - - - 表 5 榆叶梅幼苗SuSy活性方差分析统计表
Tab. 5 Statistics of variance analysis of SuSy activity in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 565.473 4 141.368 21.721 0.0002 误 差 Deviation 52.067 8 6.508 - - 总变异 Total variance 617.610 14 - - - 40d 处理间 Among treatment 810.743 4 202.686 20.050 0.0003 误 差 Deviation 80.871 8 10.109 - - 总变异 Total variance 892.301 14 - - - 60d 处理间 Among treatment 684.940 4 171.235 31.555 0.0001 误 差 Deviation 43.413 8 5.427 - - 总变异 Total variance 728.613 14 - - - 80d 处理间 Among treatment 565.938 4 141.485 45.952 0.0001 误 差 Deviation 24.632 8 3.079 - - 总变异 Total variance 591.041 14 - - - 表 6 榆叶梅叶绿素方差分析统计表
Tab. 6 Statistics of variance analysis of chlorophyll content in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 0.378 4 0.095 2.912 0.093 误 差 Deviation 0.260 8 0.033 - - 总变异 Total variance 0.640 14 - - - 40d 处理间 Among treatment 0.571 4 0.143 5.510 0.020 误 差 Deviation 0.207 8 0.026 - - 总变异 Total variance 0.787 14 - - - 60d 处理间 Among treatment 0.755 4 0.189 6.235 0.014 误 差 Deviation 0.242 8 0.030 - - 总变异 Total variance 1.003 14 - - - 80d 处理间 Among treatment 1.784 4 0.446 8.204 0.006 误 差 Deviation 0.435 8 0.054 - - 总变异 Total variance 2.229 14 - - - 表 7 榆叶梅净光合速率方差分析统计表
Tab. 7 Statistics of variance analysis of photosynthetic rate in P. triloba seedlings
处理后时间 Time after treat 变异来源 Source of variation 平方和 Square sum 自由度 Free degree 均 方 Mean square F 值 F-value p值 P-value 20d 处理间 Among treatment 8.261 4 2.065 37.854 0.0001 误 差 Deviation 0.437 8 0.055 - - 总变异 Total variance 8.726 14 - - - 40d 处理间 Among treatment 9.643 4 2.411 21.469 0.0002 误 差 Deviation 0.898 8 0.112 - - 总变异 Total variance 10.564 14 - - - 60d 处理间 Among treatment 8.996 4 2.249 38.557 0.0001 误 差 Deviation 0.467 8 0.058 - - 总变异 Total variance 9.518 14 - - - 80d 处理间 Among treatment 11.473 4 2.868 32.301 0.0001 误 差 Deviation 0.710 8 0.089 - - 总变异 Total variance 12.396 14 - - - -
[1] 赵东霞. 太原市榆叶梅繁育及园林应用技术[J]. 山西林业,2021(3):38−39. [2] 韩旭莉. 浅析土壤条件对城市园林绿化植物的重要作用[J]. 花卉,2020(8):105−106. [3] Xiong L M, Schumaker K S, Zhu J K. Cell signaling during cold, drought, and salt stress[J]. Plant Cell, 2002(14): 165−183. [4] 张娅. 外源钙缓解小麦幼苗NaCl胁迫伤害的光合碳代谢研究[D]. 兰州:西北师范大学,2022. [5] 刘艺平,苏少文,张琳,等. 外源钙对荷花适应盐胁迫的影响[J]. 浙江农业学报,2020,32(2):243−252. [6] 华智锐,李小玲. 外源钙对盐胁迫下黄芩幼苗的生理效应[J]. 江西农业学报,2020,32(1):13−18. [7] Xiang Y, Huang Y M, Xiong L Z. Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement[J]. Plant Physiology, 2007, 144(3): 1416−1428. doi: 10.1104/pp.107.101295 [8] 陈利全,黄灿雄,苏以强,等. 盐胁迫下木麻黄幼苗对外源钙的生长生理响应[J]. 林业与环境科学,2022,38(5):131−138. [9] 滕梦鑫,徐亚,于佳玄,等. 钙对盐胁迫下巴西蕉细胞生长和生理特性的影响[J]. 分子植物育种,2022,20(18):6152−6159. [10] 闫振,李进,阿丽努尔·阿卜来提,等. 外源钙对盐胁迫下单叶蔷薇种子萌发和幼苗生长的影响[J]. 草地学报,2022,30(5):1185−1193. [11] 邸桂俐,徐艳梅,高超,等. 外源Ca<sup>2+</sup>缓解玉米幼苗盐胁迫伤害的研究[J]. 黑龙江农业科学,2022(2):14−17. [12] 赵英,张佳佳,吴敏,等. 外源钙对盐胁迫下罗汉果幼苗生理效应的影响[J]. 四川师范大学学报(自然科学版),2021,44(4):555−562. [13] 刘佳. 李砧木榆叶梅对碱胁迫的响应机理研究[D]. 成都:四川农业大学,2017. [14] 刘永军. 植物生理生化实验[M]. 北京:中国农业科技出版社,2002. [15] 蔡永萍. 植物生理学实验指导[M]. 北京:中国农业大学出版社,2014. [16] Liu J R, Ma F G, Chen J, et al. Changes of sucrose metabolism in leaf subtending to cotton boll under cool temperature due to late planting[J]. Field Crops Research, 2013, 144(1): 200−211. [17] 李俊伟. 燕麦对盐胁迫和碱胁迫的响应机制[D]. 呼和浩特:内蒙古农业大学,2022. [18] 张吉立,刘振平. 氯化钠胁迫对园艺作物种子萌发及幼苗生长发育的影响[J]. 黑龙江农业科学,2007(1):50−53. [19] 郭亚宁,艾静. 盐胁迫对油白菜生长及其生理指标的影响[J]. 榆林学院学报,2023,33(2):38−41. doi: 10.16752/j.cnki.jylu.2023.02.009 [20] 周艳超,沈应柏. Ca~(2+)信号在植物细胞适应逆境中的调节作用[J]. 北方园艺,2010,(03):181−185. [21] 张吉立. 冬季4种针叶树色素动态变化研究[J]. 青海农林科技,2020(2):103−106. [22] 刘丽,曾长立. 外源钙对盐胁迫下菠菜生理特性的影响[J]. 湖北农业科学,2015,54(1):118−121. [23] 任城帅. 外源钙对氯化钠胁迫下绦柳幼苗生长及生理特性的影响研究[D]. 沈阳:沈阳农业大学,2020. [24] 张雪微,张芝蕊,江文,等. 外源钙对盐胁迫下花叶蔓长春生理生化特性的影响[J]. 天津农学院学报,2017,24(2):9−13. [25] 曹小强,赵江,周博涵,等. 叶面喷施钙素对 NaHCO<sub>3</sub> 胁迫下油菜幼苗生长及生理特性的影响[J]. 北方园艺,2023(1):11−19. [26] 张浩,郑云普,叶嘉,等. 外源钙离子对盐胁迫玉米气孔特征、光合作用和生物量的影响[J]. 应用生态学报,2019,30(3):923−930. [27] 魏翠果,陈有君,蒙美莲,等. 钙对NaCl胁迫下马铃薯脱毒苗碳水化合物代谢的影响[J]. 西北植物学报,2014,34(4):753−760. [28] Schaffer A A, Petreikov M. Sucrose-to-strach metabolism in tomato fruit undergoing transients tarch accumulation[J]. Plant Physiol., 1997(113): 739−746. [29] Bartels D, Sunkar R. Drought and salt tolerance in plants[J]. Critical Reviews in Plant Sciences, 2005, 24(1): 23−58. doi: 10.1080/07352680590910410 [30] 王旭明,赵夏夏,陈景阳,等. 盐胁迫下水稻孕穗期 SS 和 SPS 活性与糖积累的响应及其相关性分析[J]. 江苏农业学报,2018,34(3):481−486. [31] 严蓓. 钙缓解黄瓜幼苗NaCl胁迫伤害的蛋白质组学及光合碳代谢研究[D]. 南京:南京农业大学,2013. -







 下载:
下载: