-
薇甘菊(Mikania micrantha)为菊科藤本植物,通过攀缘并形成厚毯状枝叶层覆盖宿主植物,使宿主植物不能进行正常光合作用而衰亡。在2002年被列入中国首批外来入侵物种名录,目前主要通过人工铲除和化学除草剂处理,成本高,效率低下,控制时间短,除草剂对宿主植物造成伤害且污染环境,控制效果差。
据国外报道,薇甘菊柄锈菌具有生防潜力[1],国内有关引进柄锈菌利用文献报道不少,也取得了较好的效果,但未推广应用,且外来物种的入侵风险仍难以消除[2-4],程伟文报道了豆荚大茎点霉对薇甘菊的生防潜力,但仍处于试验阶段[5]。
在薇甘菊为害区域调查发现,其叶片上有一种叶斑病,侵染叶片造成叶斑及叶枯,偶发侵染茎干造成枝枯,发生严重时,薇甘菊生长明显衰退,具备作为以菌防草研究的可能。本研究通过对薇甘菊叶斑病病原菌进行分离培养、纯化、致病性测定、病原鉴定、生物学特性和寄主范围测定的研究,旨在明确病原菌,探究病原菌培养特性及对本地主栽农作物、水果、经济作物安全性,从而为该菌的利用提供初步参考。
HTML
-
薇甘菊病叶采自化州市良光镇长安村,薇甘菊覆盖桉树及橡胶林地边缘围园灌木,部分攀爬桉树及橡胶树,微甘菊新叶叶斑病发生率35%~65%,按常规方法对病害症状进行描述,并拍照。多点采集具备典型症状的叶片,保湿带回实验室,采样时间为2018年4月至5月,晴天下午采样,共采样3次,每次采集叶片10片。
-
采用常规病原体分离法进行分离[6],共分离50皿150个叶片组织块。对所分离出的真菌菌落采用琼脂平板稀释纯化法进行纯化[7],并将纯化菌株转入试管斜面,保存于4 ℃冰箱内。
-
将1.2纯化的菌株共7株接到PDA培养基上,置于自然光照培养室25 ℃±1 ℃培养2 d,在无病薇甘菊叶片中央采用无伤离体接种菌丝块,每片叶接种1个直接0.4 cm菌饼,并以接种无菌PDA培养基为对照,参试菌株7个,每个处理重复3次,每个重复接种5片叶片,保湿并室温培养,观察发病情况。若接种叶片发病则再分离,完成柯赫法则验证。
-
将病原菌(1.3回接发病的菌株共1个)接种于PDA培养基上,置于自然光照培养室25 ℃±1 ℃培养3 d,观察病原菌菌落形态、产孢情况、产孢结构和孢子形态并测量拍照。
-
病原菌分子鉴定方法参照郑樊[8]。
-
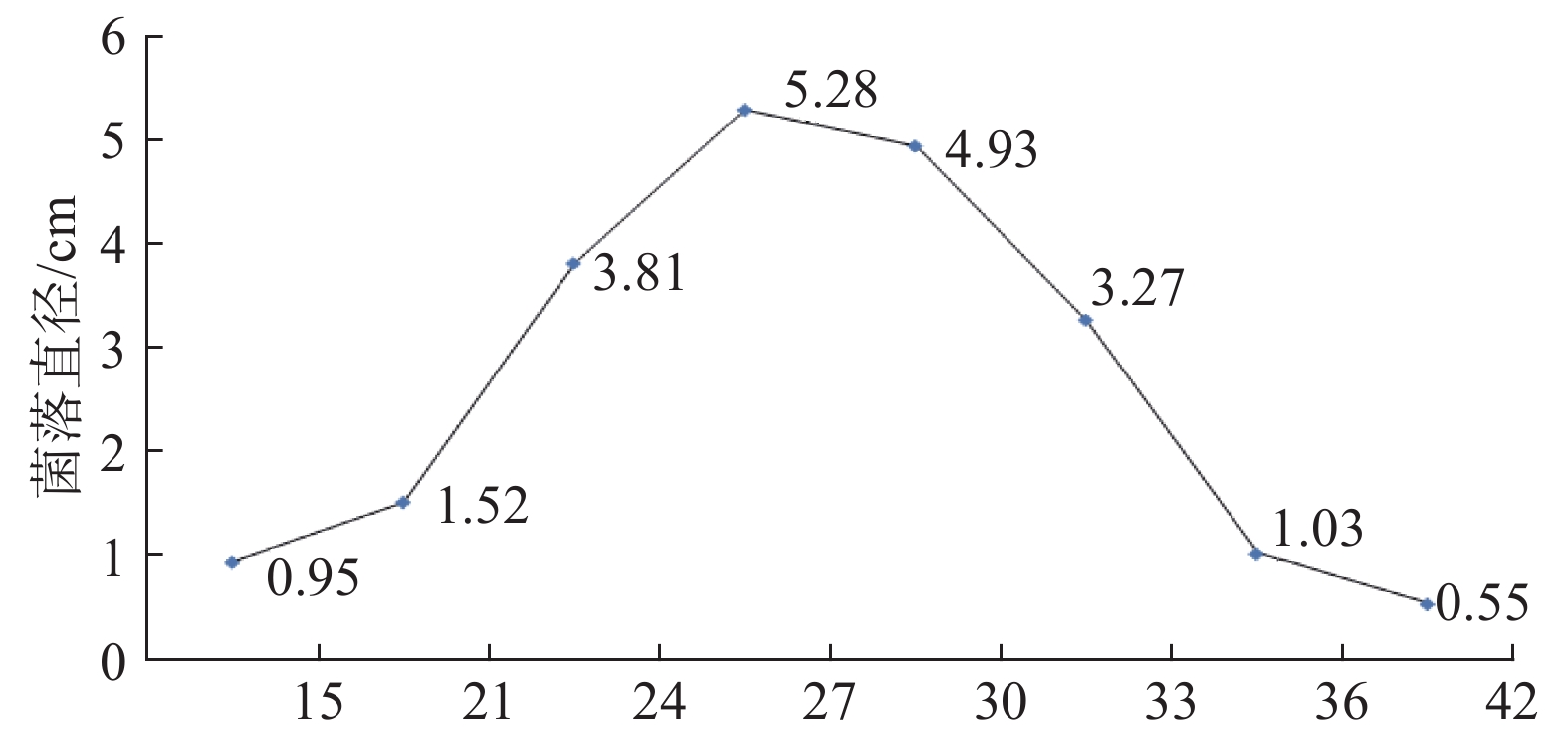
根据华南地区气温及病害发病规律,设置15、21、24、27、30、33、36及42 ℃等8个温度值进行菌丝生长试验。使用直径0.4 cm菌饼接种,培养5 d后用十字交叉法测定菌落直径,比较温度对病原菌菌丝生长的影响。
-
寄主范围测定以本地主栽农作物、水果和经济作物作为参试物,包括水稻、木薯、香蕉、龙眼、芒果、桉树、橡胶、甘蔗和桑树等。以菌丝段悬浮液喷雾无伤活体接种,将直径10 cm培养皿长满菌丝的培养基取出,加水200 mL,使用料理机打碎,过滤,加水定容为500 mL,即得接种用菌丝段悬浮液,傍晚喷雾,每个参试作物接种3次,每次喷雾5个接种点,完全喷湿接种部位叶片表面,喷雾后5 d,观察记录发病情况,包括病斑形状、大小、颜色、深度和病征,如出现侵染,在接种后15 d,观察是否出现未喷雾叶片感染,即是否出现再侵染。
1.1. 材料
1.2. 菌株的分离及纯化
1.3. 致病性测定
1.4. 病原菌鉴定
1.4.1. 形态鉴定
1.4.2. 病原菌分子生物学鉴定
1.5. 温度对病原菌菌丝生长的影响
1.6. 病原菌寄主范围测定
-
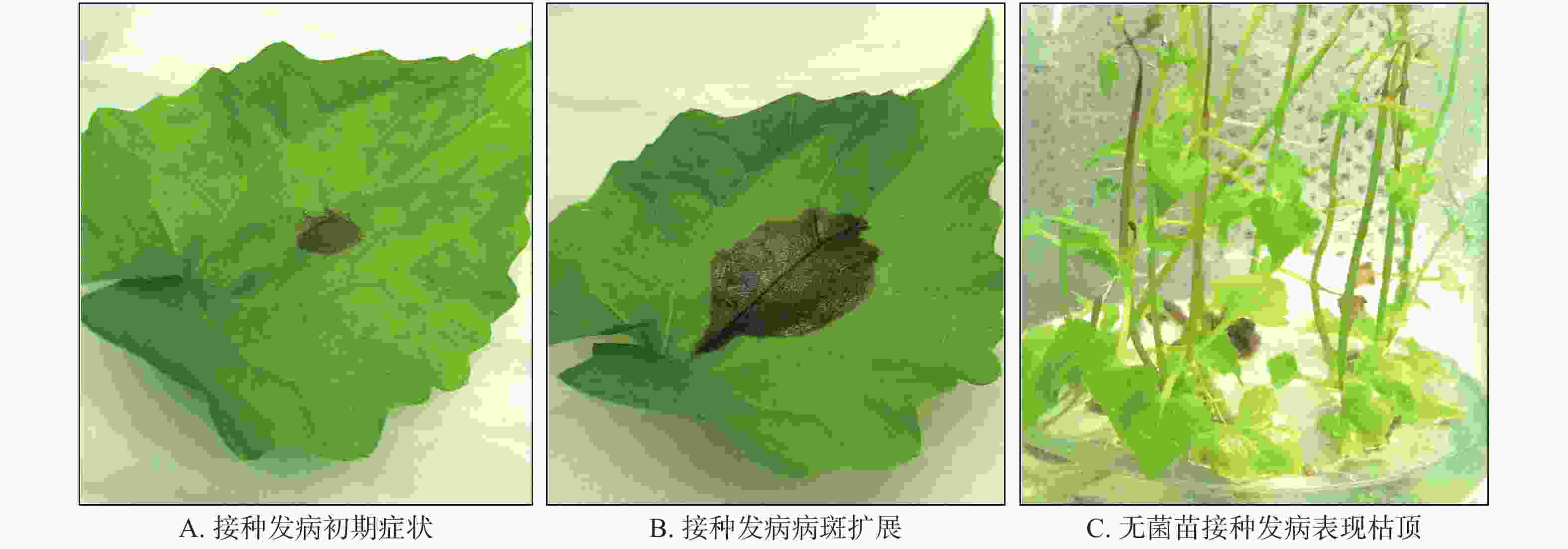
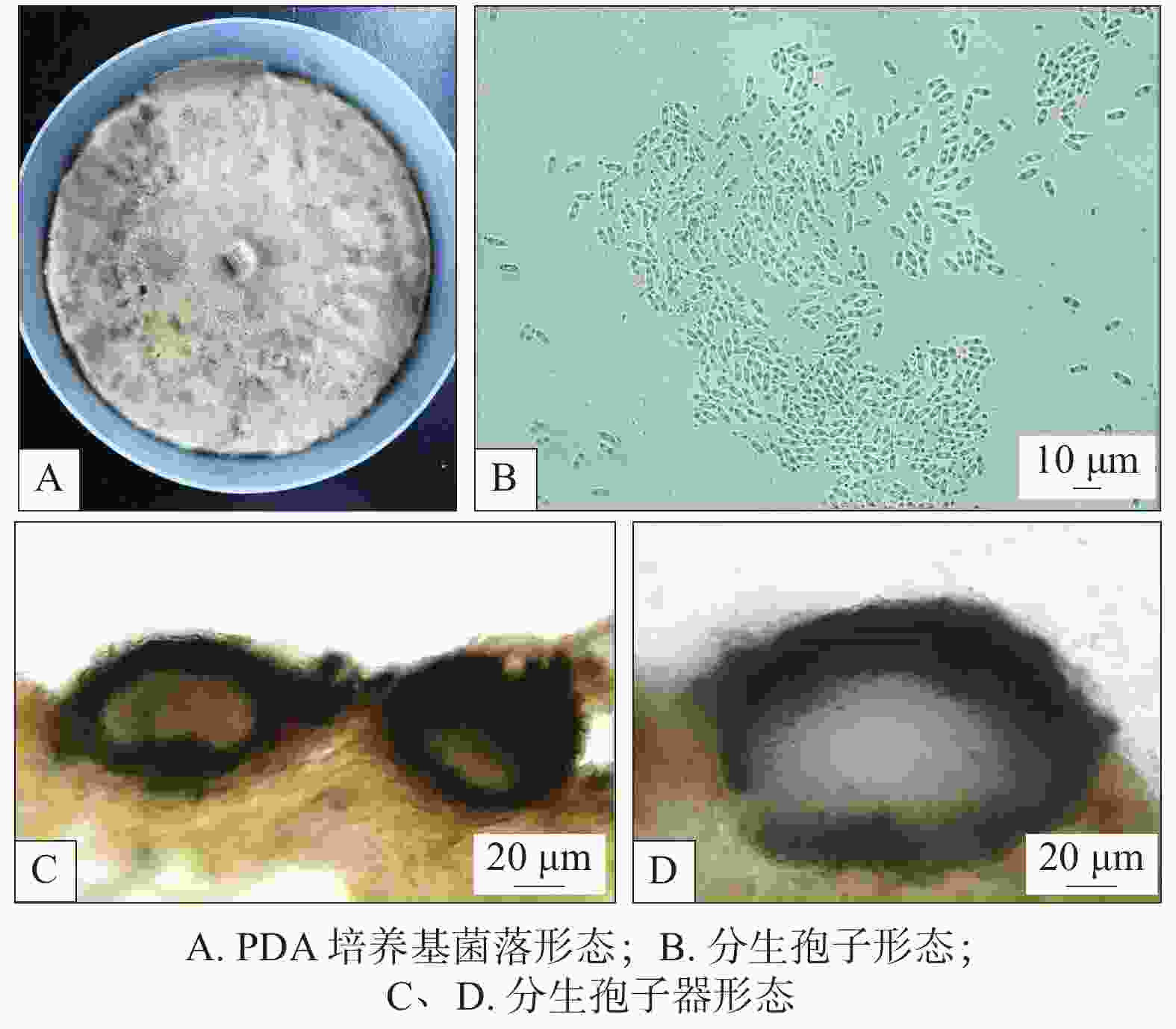
薇甘菊叶斑病能入侵薇甘菊,使叶片、叶柄及未老化茎产生病变,初期为黄褐色点状病斑(见图1A),后逐渐扩大,近圆形或沿叶脉、侧脉扩展成不规则形病斑,病斑中央植物组织易失去水分而干枯、变薄、易裂、穿孔(见图1B和C)。叶柄及枝条的病斑初期为褐色小点、略凹陷,后期不断扩大呈长条形褐色病斑,直至环绕枝条一圈。病叶保湿情况下,肉眼或用放大镜观察未见小黑点等其他病症。
-
分离纯化菌株回接只有1个致病,其余菌株和对照不发病。接种后第3天症状开始出现(见图2A),发病初期接种点呈黑色坏死,病健交界明显,随后病斑继续扩展,初期发病部位组织坏死分解(见图2B),将该菌菌落活体接种至薇甘菊无菌苗,表现为叶片及茎段发病,与田间观察到的症状相似(见图2C)。
-
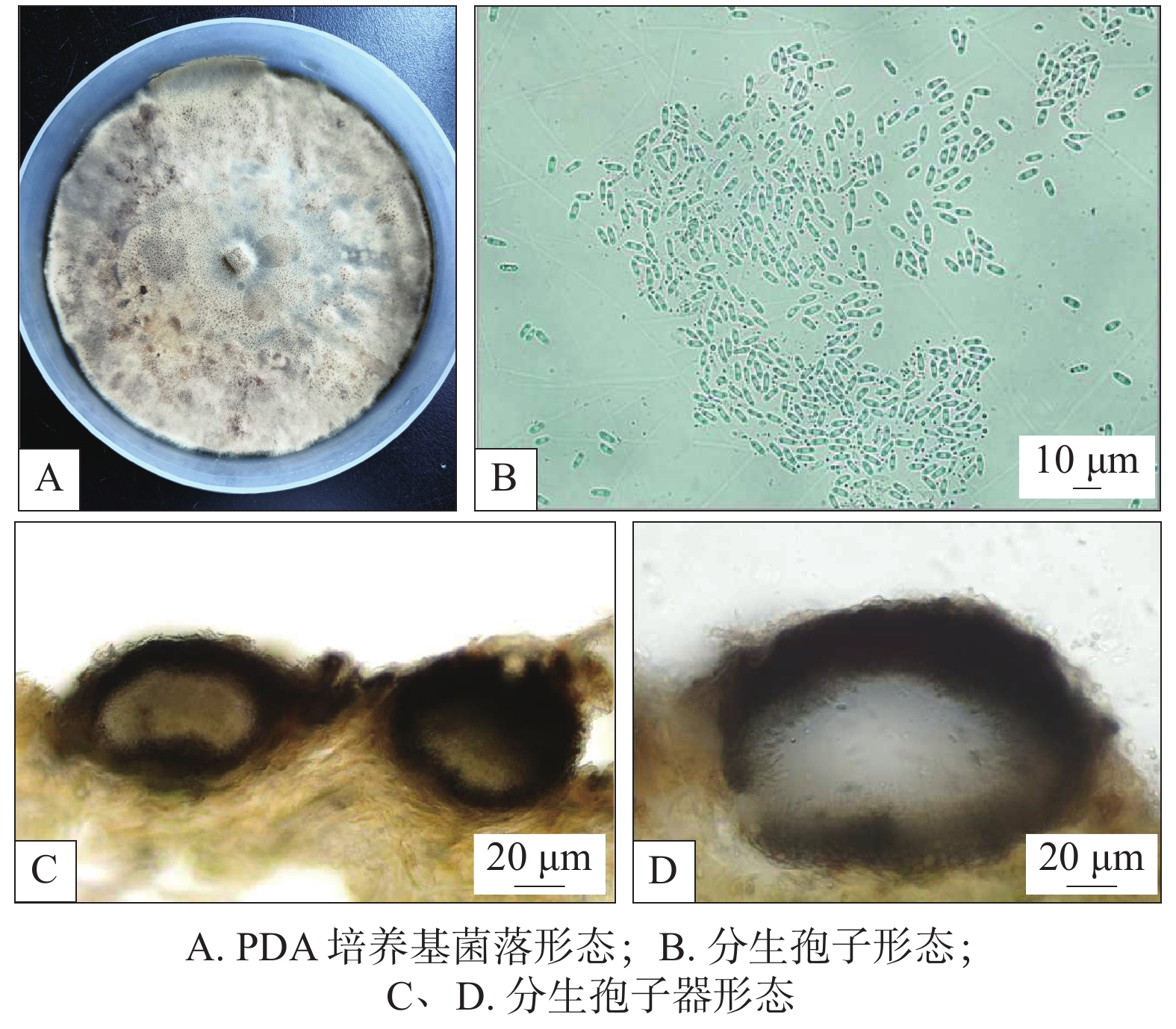
培养性状及形态在PDA上菌落圆形,边缘未老熟菌丝白色,老熟后菌丝呈黄色,菌落整体颜色初期白色后变黄褐色至深褐色(见图3A)。在PDA上不产孢,将菌丝接种于薇甘菊无菌苗可产生分生孢子器和分生孢子。
分生孢子器黑色、扁球形至球形(见图3 C和D),直径60.2~185.3 μm×72.8~159.2 μm,分生孢子椭圆形到卵圆形,无色,单胞,顶端钝圆(见图3 B),分生孢子大小:3.9~7.1 μm×1.3~3.2 μm。
-
通过ITS对引物对菌株进行PCR扩增、测序,得到长度分别为516 bp的序列。将得到的序列在GenBank中进行比对,并构建系统发育树,经MEGA7.0软件进行系统发育分析,系统发育树的各个分支的支持强度通过1 000次重复的自展检验数值进行评估。结果发现,菌株(WGJ)与Boeremia exigua聚为一个进化枝(见图4),支持率为100%。依据形态鉴定和系统发育分析,叶斑病病原菌经鉴定为Boeremia exigua。
-
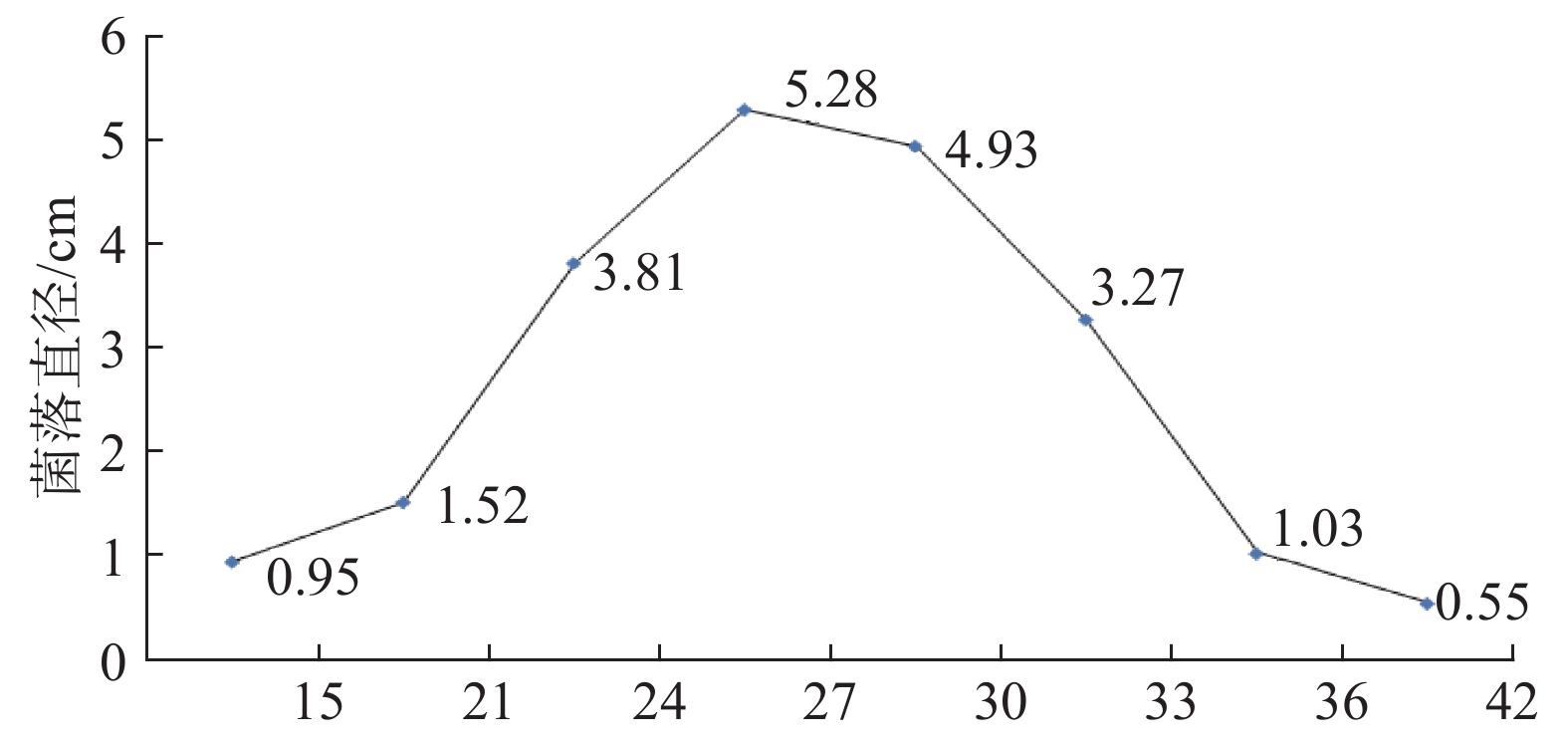
试验结果看出,15~27 ℃范围内,该病原菌菌落直径随温度升高逐渐增大;27~42 ℃范围内,菌落直径随温度升高逐渐减小。菌丝生长适宜温度为24~33 ℃,最适温度27 ℃,42 ℃时菌丝不能生长,菌落直径与接入菌饼直径相同(见图5)。
-
经菌丝段悬浮液喷雾接种,除桑树出现少量病斑,其余参试作物均未出现被侵染症状(见表1)。
物种 学名 发病 致死 再侵染 水稻 Oryza sativa L. − − − 木薯 Manihot esculenta Crantz − − − 香蕉 Musa nana Lour. − − − 龙眼 Dimocarpus longan Lour. − − − 芒果 Mangifera indica L. − − − 桉树 Eucalyptus robusta − − − 橡胶树 Hevea brasiliensis − − − 甘蔗 Saccharum officinarum − − − 桑树 Morus alba Linn. Sp. + − − 注:接种发病及再侵染程度表述,“−”表示不发病,“+”表示病斑数小于5个,平均单个病斑面积小于4 mm2,“++”表示病斑数多于5个,单个病面积小于4 mm2,病斑不连片,“+++”表示病斑数多于5个,且病斑面积大于4 mm2,或病斑连片扩展。 Table 1. Host range determination of pathogenic bacteria
由表1可知,所有参试作物,均未出现致死,仅桑树轻度发病,并未发现再侵染。
2.1. 症状描述
2.2. 病原菌致病性测定
2.3. 病原菌形态
2.4. 薇甘菊叶斑病病原系统发育分析
2.5. 温度对菌丝生长的影响
2.6. 病原菌寄主范围测定
-
经过对叶斑病的诊断和病原菌形态观察测定,包括分生孢子器形态,分生孢子形状、分生孢子大小,根据鉴定结果查阅相关资料[9],初步鉴定薇甘菊叶斑病病原菌为Boeremia属真菌,依据形态鉴定和系统发育分析,叶斑病病原菌经鉴定为大豆茎点霉Boeremia exigua。病原菌菌丝生长适宜温度为24~33 ℃,最适温度27 ℃,与野外观测发生季节一致。
病原菌寄主范围测定显示可侵染桑树,韦海玲报道Boeremia exigua可致桑断枝烂叶病[10],本研究接种未发现再侵染,具体原因有待进一步研究。王梦奇报道,Boeremia exigua可导致大豆茎点霉叶斑病[11],但大豆非本地主要作物,未开展试验。本研究过程中在使用菌丝悬浮液喷洒薇甘菊过程中,薇甘菊宿主团花树(Neolamarckia cadamba(Roxb.)Bosser)出现叶斑症状,亦无再侵染现象发生。
谷祖敏报道草茎点霉(Phoma herbarum )具备作为生物除草剂防除鸭跖草的潜力,且生物安全性良好和环境安全性良好[12]。Marcinkowska J认为,Boeremia exigua为多主寄生真菌,无寄主专化现象[13]。本研究对本地主要农作物等开展的寄主范围测定结果显示,大豆茎点霉寄主选择性较好,具备进一步开展生物除草剂研究的潜力。






















 DownLoad:
DownLoad: