-
植物光合作用对低温胁迫非常敏感,低温胁迫可引起光合效率的降低,从而影响植物的生长、产量和抗性[1]。叶绿素荧光具有迅速、灵敏、定量测定、无破坏、少干扰的特点,是光合作用能量转换的探针[2],能真实反映植物叶片光合效应及环境因子对光合作用的影响和热耗散情况,是判断植物生长状况和抗逆性强弱的重要方法[3-5]。通过监测对光抑制反应较明显的叶绿体荧光参数最大光化学效率(Fv/Fm)、光系统Ⅱ有效光量子产量(YⅡ)、非光化学猝灭系数(NPQ)和光化学淬灭系数(qP)的变化,有助于分析光合机构受低温影响的程度。
梁山慈竹(Dendrocalamus farinosus)是我国西南地区的主要丛生竹种,纤维质量较高,是优良的造纸原料。但该竹种耐寒性不强,春冬季低温影响其产量和分布,创制并选育耐寒品系是提高浆用竹林资源存量与增量的科技途径之一。离体和化学诱变获得的体细胞突变体是改良物种,拓宽其遗传资源的有效技术手段[6]。胡尚连等[7]以梁山慈竹种子成熟胚为材料,进行愈伤组织的诱导与突变体系的建立,通过离体和化学诱变获得了一批梁山慈竹体细胞突变体植株。在该成果的基础上,本研究以冷驯化的2种梁山慈竹突变体植株和对照实生植株为材料,研究其在短期系列低温胁迫后的叶绿素荧光参数变化,以期为耐寒梁山慈竹新品系的筛选提供理论依据。
HTML
-
梁山慈竹体细胞突变体植株No.101-1b和No.101-1c为2009年8月对梁山慈竹成熟胚离体诱导愈伤组织,再经过化学诱变获得[7],同期生长的梁山慈竹实生植株(CK)由西南科技大学生命科院植物细胞工程实验室提供。No.101-1b和No.101-1c植株和实生植株扩繁的后代于2012年4月移栽西南科技大学生命科学与工程学院资源圃。取自然环境下长势良好且一致的1年生No.101-1b、No.101-1c和CK植株在直径30 cm、高35 cm的陶瓷盆中培育。在低温胁迫处理前,将各品系植株在11月室外(昼夜平均温度为15 ℃/8 ℃)的自然条件下冷驯化26 d。
-
先将各植株在室温15 ℃暗环境下放置20 min,保持黑暗条件,用Imaging-PAM调制叶绿素荧光成像仪(德国Walz公司)测定顶端起第一枝条、枝稍起第3片完全展开成熟叶的叶绿素荧光参数Fv/Fm、YⅡ、NPQ、qP,再将植株置于遮光的GDW型高低温试验箱(升降温速率0.70 ℃·min−1~1.00 ℃·min−1)内,设置4 ℃、0 ℃、−5 ℃、−10 ℃、−15 ℃等温度梯度,在每一温度各处理90 min后于暗环境下依次测量上述4项叶绿素荧光参数直至植株失去生命体征(表现为NPQ及qP趋近为0),以CK为对照。每组3次重复,测量光强度PAR为81·μmol·m−2·s−1。
-
采用SPSS19.0统计分析软件(SPSS Inc., USA)对叶绿素荧光参数进行两因素方差分析,分别检验温度、品系主效应和两者间交互效应。对同一品系不同温度、同一温度不同品系的叶绿素荧光参数分别进行单因子方差分析(One-way ANOVA),最小显著差数法(LSD法)进行多重比较。显著水平α定为0.05。Excel 2007制表并作图。
1.1. 试验材料及预处理
1.2. 叶绿素荧光参数测定
1.3. 数据分析
-
在系列低温胁迫下,2个体细胞突变体植株的存活情况不尽相同。表1显示,对照CK在−5 ℃胁迫下死亡(胁迫后NPQ及qP趋近为0),而突变体No.101-1b和No.101-1c在-15 ℃胁迫下死亡。
品系
strain温度temperature/℃ 15/8 4 0 −5 −10 −15 CK + + + − − − No.101-1b + + + + + − No.101-1c + + + + + − 注:+表示植株均存活,−表示植株均死亡
Notes: The symbol + means that all the plants are alive, while the symbol − means that all the plants are deadTable 1. Survival of seedling plants and somatic mutant plants of Dendrocalamus farinosus under low temperature stress
-
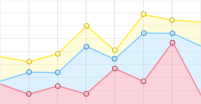
植物可变荧光Fv与最大荧光Fm的比值Fv/Fm能够良好地反映光合色素把捕获的光能转化为化学能的速度和效率[8]。当植物处于逆境或受伤害时Fv/Fm值会明显降低,意味着光合作用受到抑制[9-10]。由图1可以看出,15/8 ℃时对照CK和突变体No.101-1b的Fv/Fm值差异不显著,突变体No.101-1c的Fv/Fm值比前两者更低,差异显著。但CK的Fv/Fm值在4 ℃和0 ℃下相对于15/8 ℃剧烈下降,平均降幅达33.54%,且经–5 ℃低温胁迫后死亡。No.101-1b的平均下降幅度比CK小,为19.53%,且经过4 ℃、0 ℃、–5 ℃、–10 ℃ 4个梯度胁迫,直到−15 ℃胁迫后死亡。No.101-1c经5个梯度低温胁迫后也出现死亡,但平均降幅仅为4.03%,且在4 ℃时Fv/Fm值降低后,从0 ℃起出现回升趋势,表现出较好的耐寒性。
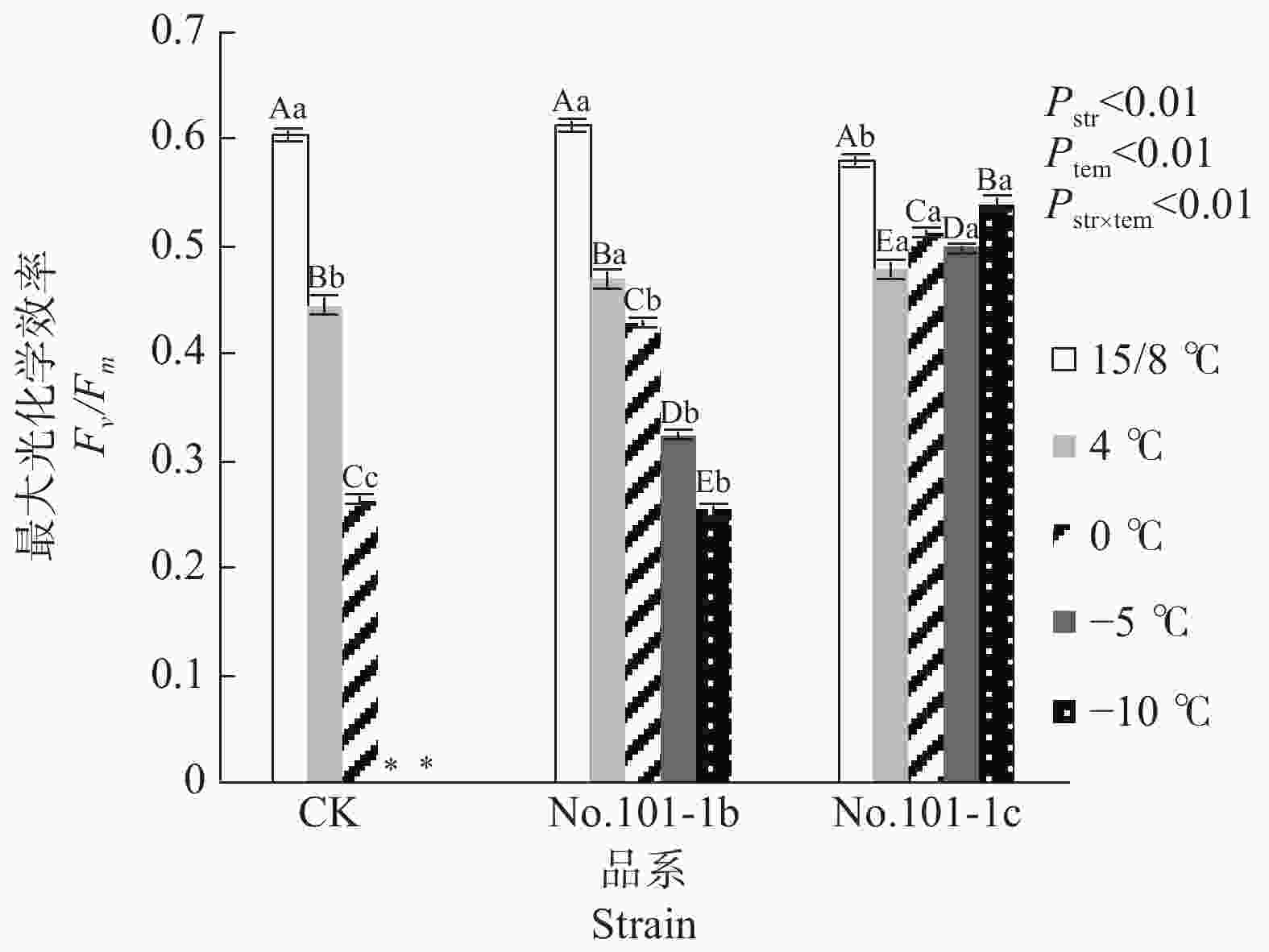
Figure 1. Changes of Fv/Fm values in Dendrocalamus farinosus seedling plants and somatic mutant plants under different low temperature stress
双因子方差分析结果表明,品系和温度都对Fv/Fm值有极显著影响,且因温度降低而变化的Fv/Fm值在不同品系间有极显著差异(P值均小于0.01)。
-
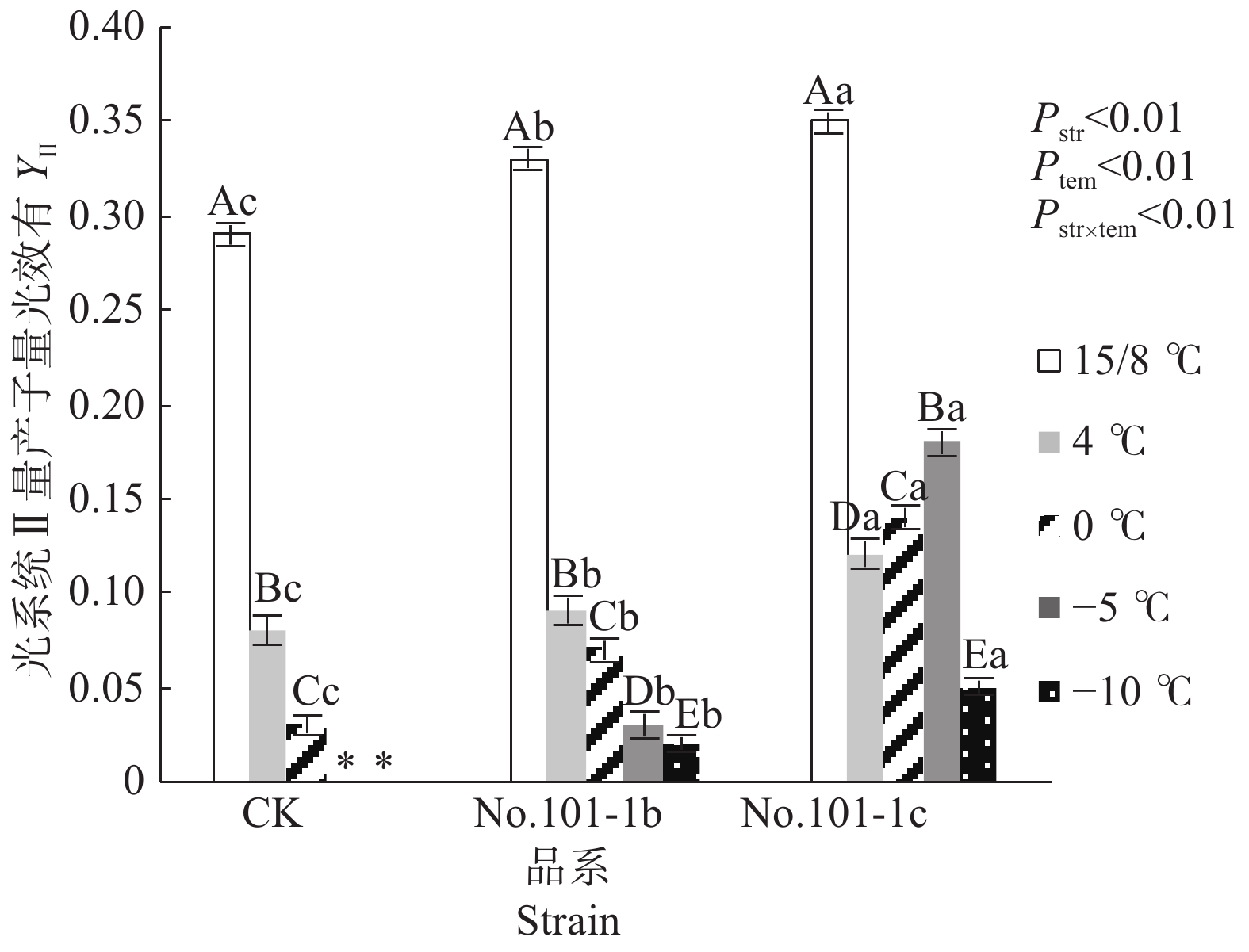
YⅡ值代表光系统Ⅱ的实际量子产量,它反映了植物的实际光合效率。低温胁迫下YⅡ值降低越缓慢的植株碳源积累的效率越高,将光抑制降到最低的能力越强[11]。由图2可知,15/8 ℃时对照CK、突变体No.101-1b和突变体No.101-1c的YⅡ值有显著差异,No.101-1c>No.101-1b>CK。4 ℃起CK的YⅡ值经低温胁迫后迅速下降(–5 ℃及以下的低温已造成植株全部死亡而无数据),平均降幅达67.46%。No.101-1b的YⅡ值随温度降低也明显下降,但整体上比CK下降平缓,平均降幅46.35%。No.101-1c的YⅡ值平均降幅23.17%,且0 ℃~–5 ℃范围内的YⅡ值相对于4 ℃时升高,直到–10 ℃下回落,说明其具有较高的碳源积累效率,更有利于维持光合能力。
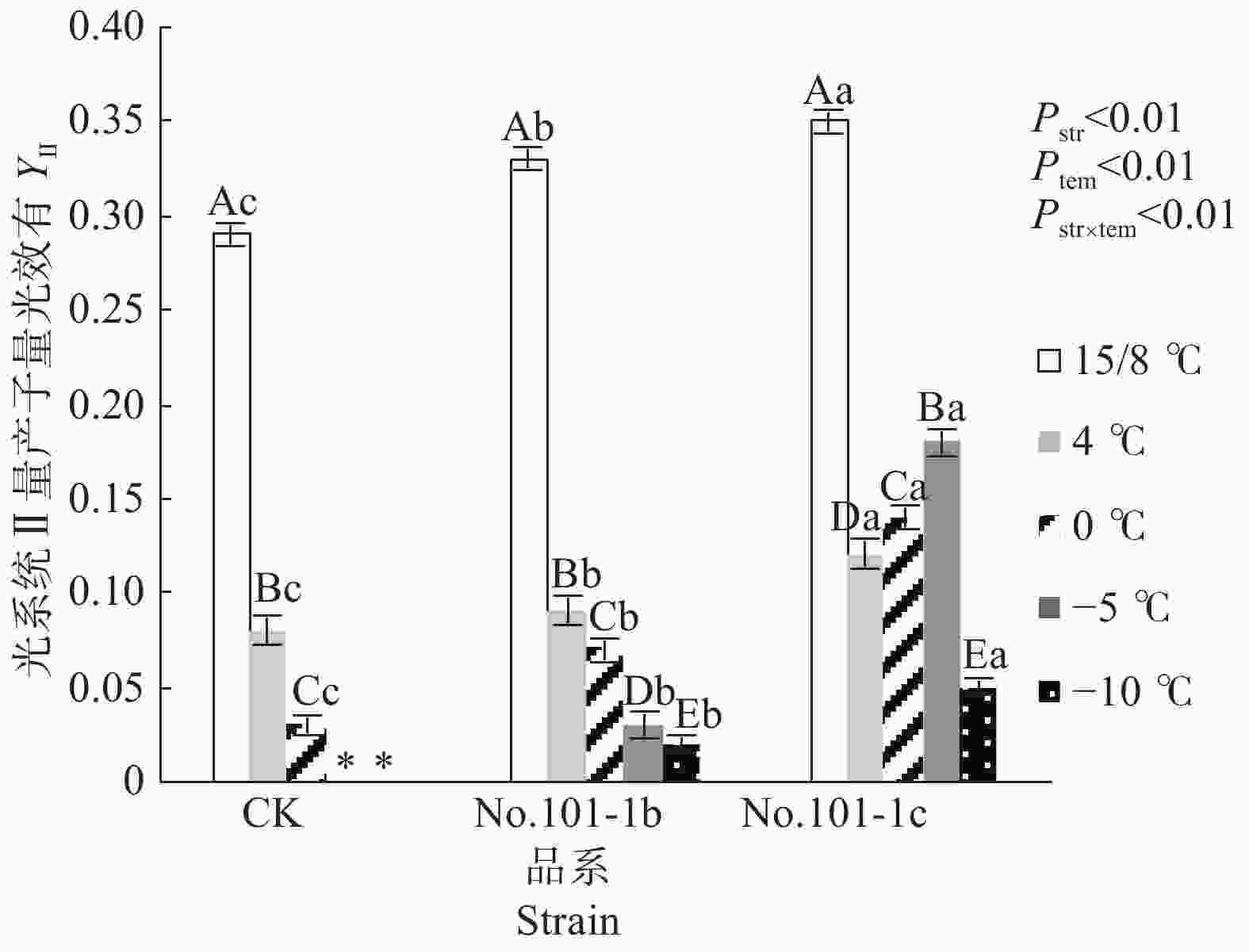
Figure 2. Changes of YⅡ values in Dendrocalamus farinosus seedling plants and somatic mutant plants under different low temperature stress
双因子方差分析结果表明,品系和温度都对YⅡ值有极显著影响,且因温度降低而变化的YⅡ值在不同品系间有极显著差异(P值均小于0.01)。
-
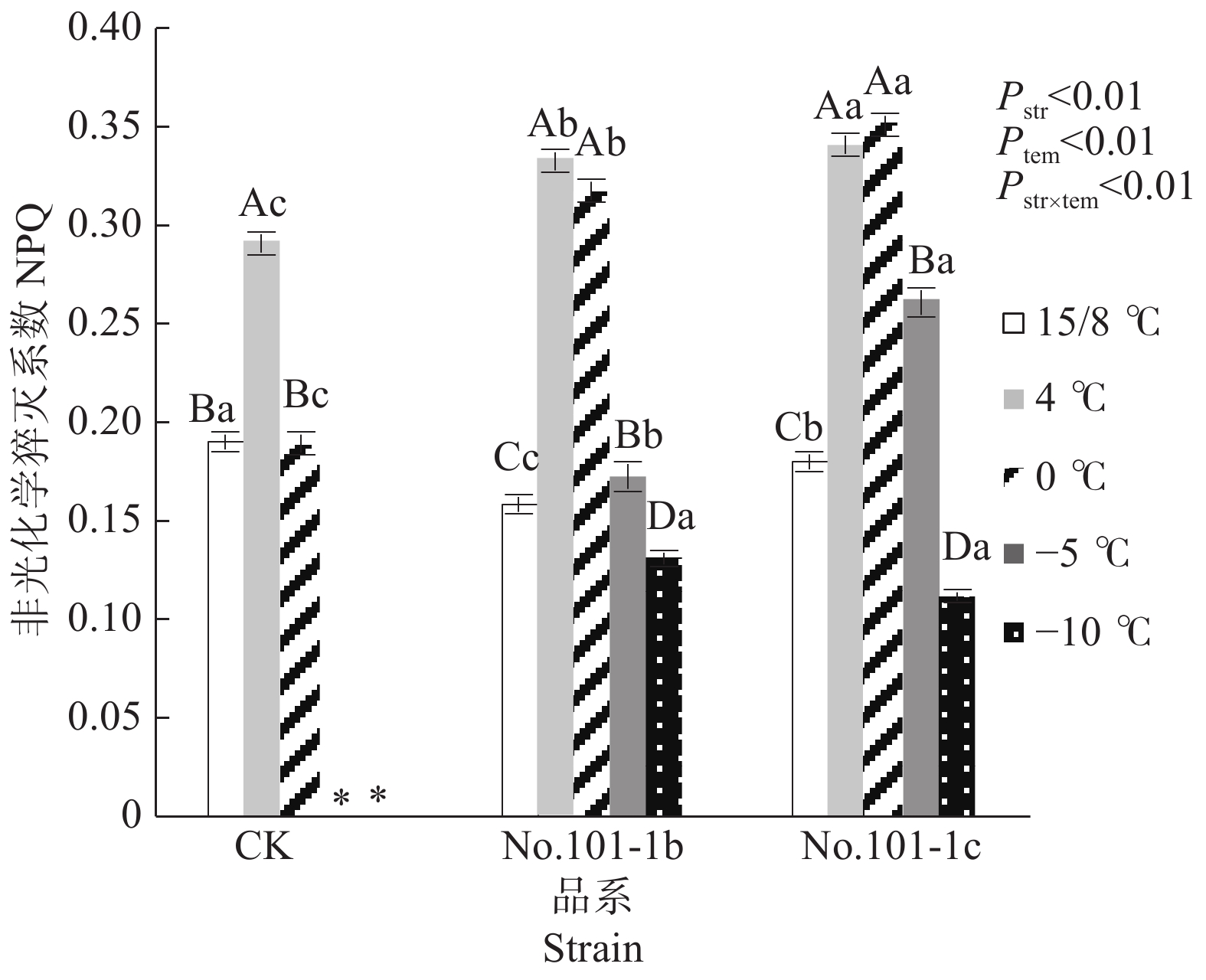
NPQ是包括热耗散及其他能量耗散过程在内的非光化学猝灭系数,它反映了植物耗散过剩光能的能力,暗示植物已启动了光保护反应以避免过量光伤害[12]。从图3可以看出,15/8 ℃时对照CK、突变体No.101-1b和突变体No.101-1c的NPQ值有显著差异,CK>No.101-1c>No.101-1b。4 ℃时,CK、No.101-1b和No.101-1c的NPQ值均显著升高,分别升高52.67%、109.43%、89.27%,0 ℃时CK相对于15/8 ℃无明显变化,而突变体No.101-1b和No.101-1c仍保持上升规律,分别比15/8 ℃升高99.62%和95.16%,这说明CK在低温胁迫下保护自身的能力较低,No.101-1b和No.101-1c较高。
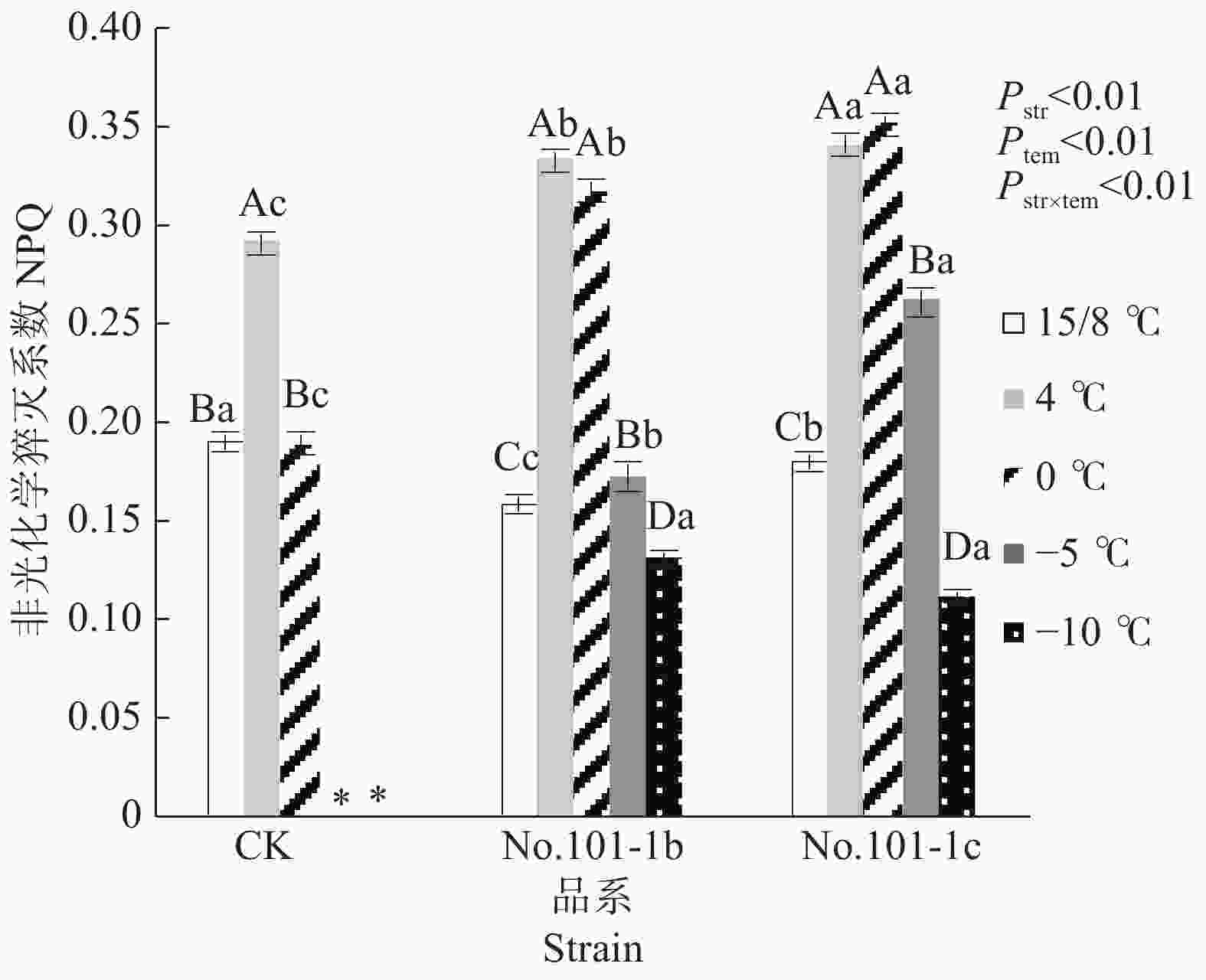
Figure 3. Changes of NPQ values in Dendrocalamus farinosus seedling plants and somatic mutant plants under different low temperature stress
双因子方差分析及交互检验结果表明,品系和温度都对NPQ值有极显著影响,且因温度降低而变化的NPQ值在不同品系间有极显著差异(P值均小于0.01)。
-
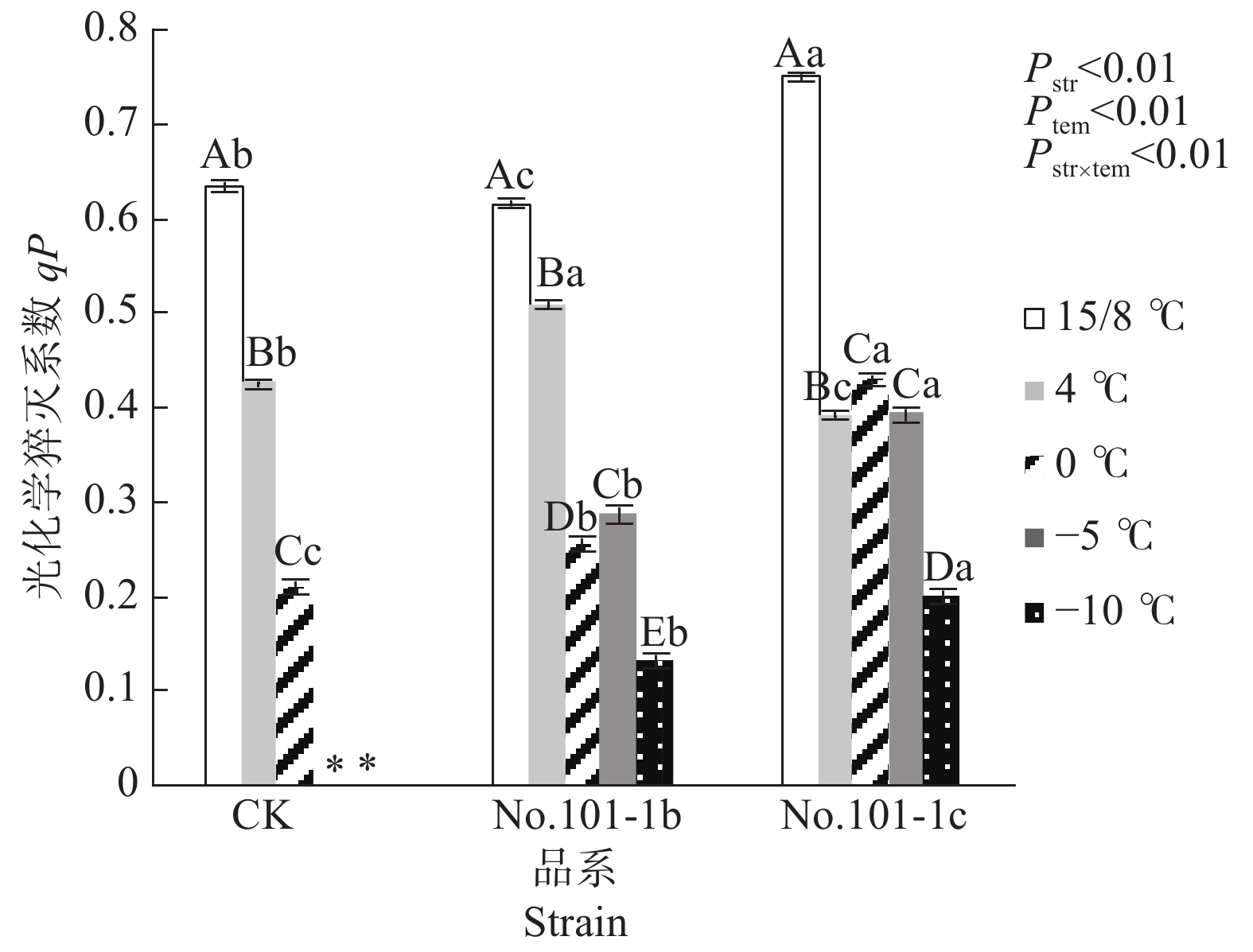
由光合作用引起的荧光淬灭称为光化学淬灭qP,它反映了植物光合活性的大小。高qP值可以加速推动光合电子传递能力,促进光合效率增长[13]。由图4可知,15/8 ℃时对照CK、突变体No.101-1b和突变体No.101-1c的qP值有显著差异,No.101-1c> CK > No.101-1b。之后,梁山慈竹各品系植株在低温胁迫后的qP值均下降,显著低于15/8 ℃。4 ℃下qP降幅排序为No.101-1c> CK> No.101-1b(分别为35.93%、20.97%、10.77%),而0 ℃时各品系植株的qP值与15/8 ℃时相比,CK降幅最大(66.93%),突变体No.101-1b和No.101-1c降幅依次减小(分别为58.61%、42.91%)。−5 ℃和−10 ℃下,No.101-1b相对15/8 ℃的qP值降幅一直大于No.101-1c。qP平均值方面,如果已死亡植株的qP值按0计,那么经低温胁迫后No.101-1c的qP平均值最高,No.101-1b居中,CK最小。
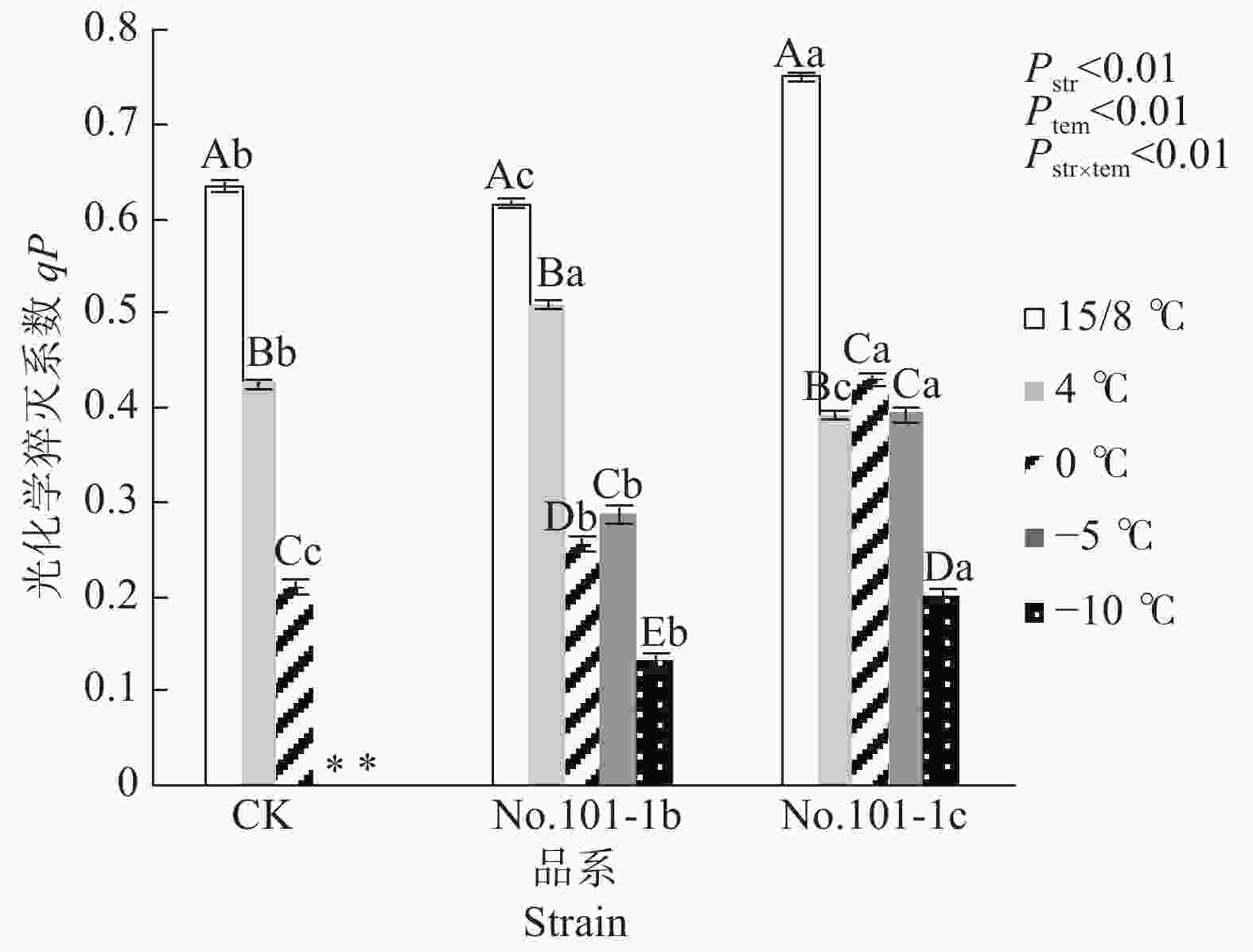
Figure 4. Changes of qP values in Dendrocalamus farinosus seedling plants and somatic mutant plants under different low temperature stress
双因子方差分析及交互检验结果表明,品系和温度都对qP值有极显著影响,且因温度降低而变化的qP值在不同品系间有极显著差异(P值均小于0.01)。
2.1. 低温处理对梁山慈竹体细胞突变体植株存活的影响
2.2. 低温处理对梁山慈竹体细胞突变体植株Fv/Fm的影响
2.3. 低温处理对梁山慈竹体细胞突变体植株YⅡ的影响
2.4. 低温处理对梁山慈竹体细胞突变体植株NPQ的影响
2.5. 低温处理对梁山慈竹体细胞突变体植株qP的影响
-
低温会抑制光系统Ⅱ的活性,使其光能捕捉能力与光化学转化效率降低、热耗散比例增高、反应中心的开放率下降,甚至对光合结构产生不可逆的破坏,从而使叶绿素荧光参数发生变化[14-15]。本研究中2个体细胞突变体植株的Fv/Fm、YⅡ和qP的值大多随着低温胁迫的加剧而降低,也说明植物光系统Ⅱ反应中心开放率受到影响,实际光合效率和光合活性均受到明显抑制[16-18]。NPQ的值随着低温胁迫的加剧而增大,说明植物通过热耗散消耗多余热量来抵御过剩光能伤害,使光合作用能量达到新的平衡来适应胁迫环境[15][18]。对比突变体植株No.101-1b和实生植株CK,突变体植株No.101-1c的各项叶绿素荧光参数都表现出较强的生态适应性和耐寒性,表明叶绿素荧光参数可作为低温胁迫时竹类植物受伤情况和抗冻能力的鉴定指标[19],也是遗传育种筛选耐寒品系的有效手段。
经历春冬季低温后,气温逐渐回暖,部分耐寒植物能重新恢复生机,所以研究解除低温胁迫后植物叶绿素荧光参数的响应同样是筛选耐寒植物方法之一。温度逐步恢复后,部分光合功能失活的竹类植物可呈现两种状态:一种发生可逆失活,光抑制迅速恢复,这可能是反应中心部分失活所致。一种发生不可逆失活,完全没有恢复迹象,表明低温胁迫严重破坏了反应中心[20-21]。此外,高温胁迫会破坏竹类植物的光系统,表现为光系统Ⅱ反应中心的失活、Fv/Fm降低、捕光叶绿素ab蛋白复合物降解等[22]。由此,低温胁迫后的梁山慈竹体细胞突变植株的恢复,以及高温胁迫对体细胞突变植株生存适应影响等方面,有待进一步研究。
近年来,我国已成为世界上竹浆产量和使用量最大的国家,竹浆也成为我国竹产业新的重要经济生长点,对我国生态保护、乡村振兴、农民增收、产业安全保障都具有深刻的影响[23]。本研究已初筛出梁山慈竹体细胞突变体植株No.101-1c具有较强的耐寒性能,但其在纤维素含量、木质素含量、纤维形态、适地引种、高产稳产等方面还需要进一步探索,以期为西南地区浆用竹原料基地的优存量、促增量建设提供竹种选用的科学依据。



















 DownLoad:
DownLoad: